Furan
| Furan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Cząsteczka furanu |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Synonimy |
Furfuranne |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O ECHA | 100,003,390 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O WE | 203-727-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 8029 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 35559 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| UŚMIECHY |
C1 = COC = C1 , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / C4H4O / c1-2-4-5-3-1 / h1-4H Stand. InChI: InChI = 1S / C4H4O / c1-2-4-5-3-1 / h1-4H Stand. InChIKey: YLQBMQCUIZJEEH-UHFFFAOYSA-N |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | klarowna bezbarwna ciecz stopniowo brązowiejąca o charakterystycznym zapachu. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości chemiczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formula |
C 4 H 4 O [Izomery] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa cząsteczkowa | 68,074 ± 0,0038 g / mol C 70,57%, H 5,92%, O 23,5%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moment dwubiegunowy | 0,66 ± 0,01 D. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Średnica molekularna | 0,502 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości fizyczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fuzja | -85,6 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * Temperatura wrzenia | 31,5 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rozpuszczalność | 10 g · l -1 (woda, 20 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametr rozpuszczalności δ |
19,2 MPa 1/2 ( 25 ° C ); 18,6 J 1/2 · cm -3/2 ( 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa objętościowa |
0,9644 g · cm -3 ( 0 ° C )
równanie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura samozapłonu | 390 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura zapłonu | -35 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Granice wybuchowości w powietrzu | 2,3 - 14,3 % obj | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nasycenie prężności par |
0,658 bar przy 20 ° C 1,0 bar przy 30 ° C 1,907 bar przy 50 ° C 3,105 bar przy 65 ° C równanie:
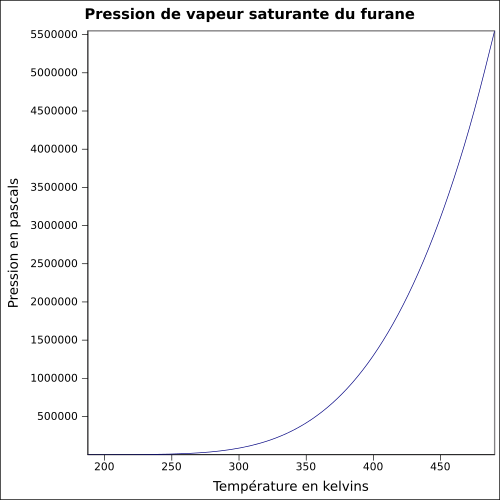
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punkt krytyczny | 55,0 bar , 217,05 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochemia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
równanie:
równanie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości elektroniczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 energia re jonizacji | 8,883 ± 0,003 eV (gaz) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości optyczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Współczynnik załamania światła | 1.4187 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Środki ostrożności | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Niebezpieczeństwo H224, H302, H315, H332, H341, H350, H373, H412, EUH019, P201, P210, P261, P273, P281, P311, H224 : Skrajnie łatwopalna ciecz i pary H302 : Działa szkodliwie po połknięciu H315 : Działa drażniąco na skórę H332 : Działa szkodliwie przez drogi oddechowe H341 : Podejrzewa się, że powoduje wady genetyczne (wskazać drogę narażenia, jeżeli definitywnie udowodniono, że żadna inna droga narażenia nie prowadzi do tego samego zagrożenia ) H350 : Może powodować raka (wskazać drogę narażenia, jeżeli definitywnie udowodniono, że żadna inna droga narażenia nie powoduje takiego samego zagrożenia) H373 : Przypuszczalne ryzyko `` poważnego wpływu na narządy '' (wymienić wszystkie narządy dotknięte chorobą, jeśli są znane) po wielokrotnym narażenie lub narażenie długotrwałe (wskazać drogę narażenia, jeżeli definitywnie udowodniono, że narażenie na inną drogę nie prowadzi do tego samego zagrożenia) H412 : Działa szkodliwie na organizmy wodne, powodując długotrwałe skutki EUH019 : Może tworzyć wybuchowe nadtlenki P201 : Przed uzyskaniem specjalnych instrukcji posługiwać się. P210 : Przechowywać z dala od źródeł ciepła / iskier / otwartego ognia / gorących powierzchni. - Zakaz palenia. P261 : Unikać wdychania pyłu / dymu / gazu / mgły / par / rozpylonej cieczy. P273 : Unikać uwolnienia do środowiska. P281 : Stosować wymagane środki ochrony indywidualnej. P311 : Skontaktować się z OŚRODKIEM ZATRUĆ lub lekarzem. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B2, D1A, D2A, B2 : Substancja ciekła łatwopalna D1A : Materiał bardzo toksyczny, powodujący natychmiastowe poważne skutki D2A : Materiał bardzo toksyczny powodujący inne skutki toksyczne Stwierdzenie na poziomie 0,1% zgodnie z kryteriami klasyfikacyjnymi |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 2 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
33 : wysoce łatwopalny materiał ciekły (temperatura zapłonu poniżej 21 ° C ) Numer UN : 2389 : FURANNE Klasa: 3 Etykieta: 3 : Ciecze łatwopalne Opakowanie: Grupa pakowania I : towary bardzo niebezpieczne;  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klasyfikacja IARC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa 2B: prawdopodobnie rakotwórczy dla ludzi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekotoksykologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 |
7 mg · kg -1 (mysz, ip ) 5,2 mg · kg -1 (szczury, ip ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CL 50 | Szczur: 20 ppm przez 4 godziny | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 1.34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jednostki SI i STP, chyba że określono inaczej. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Furan , pisze furan , jest związek chemiczny o wzorze empirycznym C 4 H 4 O. Jest to związek heterocykliczny należący do klasy metaloli , składający się z pierścienia aromatycznego z pięcioma atomami , w tym jednym atomem tlenu . Występuje w postaci płynnej, bardzo lotnej, bezbarwnej. Posiadając reaktywność inną niż benzen , jest stosowany jako odczynnik lub prekursor w chemii organicznej .
Synteza
Furan został po raz pierwszy zsyntetyzowany w 1870 roku przez Heinricha Limprichta, a następnie nazwano go tetraphenolem .
Synteza przemysłowa
Jednym z głównych źródeł furanu jest furoaldehyd , otrzymywany przez destylację produktów pochodzenia roślinnego, w szczególności zbóż. Furoaldehyd jest następnie katalizowany, dekarboksylowany z wytworzeniem furanu. Znane są dwie drogi syntezy:
- Oryginalna metoda przekształca furoaldehyd w furan, wodór H 2i dwutlenek węgla CO 2w obecności pary wodnej H 2 Oa katalizator stanowi Zn - Fe i Zn - Mn . Mieszaninę para-furfural o stosunku 1: 5-1: 10 ogrzewa się do 400 ° C, a wydajność furanu przekracza 90%.
- W 1959 roku firma DuPont opracowała metodę syntezy wykorzystującą katalizator platynowy , co pozwoliło uniknąć użycia pary. Furfural jest bezpośrednio rozkładane na furanów i tlenku węgla ciśnienie i CO w temperaturze 200 ° C .
Inną możliwością jest częściowe utlenianie 1,3-butadienu . Technika ta została opracowana przez firmę DuPont w 1957 roku. W reakcji wykorzystuje się tlenek molibdenu MoO 3jako katalizatora, w temperaturze 500 ° C . Na tę reakcję pozwalają również różne katalizatory: tlenek fosforu i wanadu lub tlenek antymonu domieszkowany cyną , miedzią lub nawet wolframem . Jednak plony są mniejsze niż 15%.
DuPont kontynuował rozwój wzdłuż tej ścieżki iw 1987 roku opracowano proces w niskiej temperaturze (od 90 do 120 ° C ). Odczynnik 1,3-butadienu odparowuje się, a następnie utlenia dichlorkiem miedzi w wodnym roztworze mono- i dichlorku miedzi w obecności chlorku sodu, jodku potasu i kwasu solnego. W przypadku konwersji 1,3-butadienu wynoszącej 20% odnotowano selektywność powyżej 90 %.
Synteza laboratoryjna
Furan i jego podstawione pochodne można otrzymać z otwartych układów, co umożliwia bezpośredni dostęp do wysoce sfunkcjonalizowanych pochodnych, w szczególności odwodnienie podstawionych pentano-2,4-dionów umożliwia dostęp do 3,4-furanów. inne trasy. Paal-Knorr synteza jest jednym z najprostszych syntezy i umożliwia z 1,4- diketonu i pentatlenkiem fosforu P 4 O 10 dostać furan.
Synteza Feist-Benary reakcji karboanionu estru β-keto karbonylowej alfa-chlorowco-ketonem i wewnątrzcząsteczkowe nukleofilowego podstawienia ma miejsce, tworząc pierścień, który daje po suszeniu furanowym.
Inne syntezy furanu są możliwe z cykloaddycji lub reakcji Dielsa-Aldera .
Właściwości fizykochemiczne
Furan jest bezbarwną cieczą w normalnych warunkach temperatury i ciśnienia . Jest bardzo lotny i ma niską temperaturę wrzenia . W NMR z protonu furan dwa piki masy w deuterowanym chloroformie CDCI 3 : 7,4 ppm dla wodorów α tlenu , 6,3 ppm dla wodorów β. W NMR z węgla , furan wykazuje dwa piki przy 142 ppm do 1 do 5 atomach węgla, 109 ppm do węgla 2 i 4 furanowy jest bardzo dobrze rozpuszczalna w acetonie , rozpuszczalny w metanolu i w eterze dietylowym i bardzo słabo rozpuszczalny w wodzie. Współczynnik załamania światła wynosi 1,421.
Aromatyczność
Furan to aromatyczny związek, który szanuje regułę Hückela . Ma sześć zdelokalizowanych elektronów: cztery dostarczane przez podwójne wiązania i dwa przez atom tlenu (jeden z dwóch niewiążących dubletów ). Każdy węgiel przenosi jeden ze swoich elektronów π podczas delokalizacji, a tlen przenosi dwa elektrony. Węgle są zhybrydyzowane sp 2 . Furan ma energię rezonansu między 62,3 a 96,2 kJ mol -1 . Ta energia jest niższa niż w przypadku benzenu , tiofenu i pirolu : furan jest zatem związkiem mniej aromatycznym niż ten ostatni. Ta niska aromatyczność wyjaśnia, dlaczego furan działa jako cykliczny dien w niektórych reakcjach Dielsa-Aldera .
Atom tlenu ma mezomeryczny efekt donora i indukcyjny efekt atraktora w furanie. Delokalizacja niewiążącego dubletu stanowi efekt mezomeryczny tlenu, podczas gdy przyciąganie elektronów z wiązań CO do atomu tlenu odpowiada efektowi indukcyjnemu . Charakter atraktora indukcyjnego wpływa na rozkład elektronów w cyklu, ale nie jest w stanie zrównoważyć efektu mezomerycznego. Tlen zapewnia zatem globalnie dodatkową gęstość elektronów w cyklu. Ten udział elektronów tlenu powoduje wartości gęstości elektronów większe niż 1 dla węgli w cyklu. Efekt mezomeryczny donora generuje dodatni ładunek tlenu w czterech mezomerycznych formach furanu i zdelokalizowany ładunek ujemny na atomach węgla w pierścieniu.
Atom tlenu ma inny dublet, który nie jest zdelokalizowany. Furan jest związkiem planarnym. Podobnie jak jego odpowiedniki tiofenowe lub pirolowe , jego cykl jest nadwyżką elektryczną. W rzeczywistości ma sześć elektronów π rozłożonych na pięć atomów; gęstość elektronów jest zatem znacznie wyższa niż w przypadku analogów benzenu. Z drugiej strony, w przeciwieństwie do prostych sześcioczłonowych pierścieni aromatycznych, tylko jedna z jego form rezonansowych jest obojętna, pozostałe występują w postaci obojnaczej . Ponieważ te naładowane formy są w mniejszości, chemia furanu jest częściowo pochodną związków aromatycznych, a częściowo dienów.
Reaktywność furanu
Różne rodzaje reaktywności
jak aromatyczneW przypadku furanu będącego nadwyżką elektryczną, reakcje elektrofilowej substytucji aromatycznej są znacznie szybsze niż w przypadku analogów benzenu . Dzięki temu możliwe jest prowadzenie reakcji halogenowania , sulfonowania , metalowania itp. Furan jest tak reaktywny, że może ulegać acylowaniu Friedela-Craftsa nawet bez obecności katalizatora .
Najkorzystniejszymi pozycjami dla reakcji podstawienia są pozycje 2 i 5 (w α tlenu). Kiedy oba są dostępne, trudno jest zatrzymać się na monopodstawieniu. Gdy pozycje 2 i 5 są zajęte, reakcje zachodzą na pozostałych pozycjach.
jak dieneFuran i jego pochodne mogą reagować jako dieny lub też jako związki aromatyczne w zależności od podstawników w pierścieniu. Niepodstawiony furan reaguje szczególnie dobrze jako dien w reakcjach cyklizacji typu Dielsa-Aldersa ze względu na jego niską aromatyczność. Podobnie alkilowe furany alkoksy furanów i furfurylowy estry i etery wykazują dobrą reaktywność w reakcji Dielsa-Aldera . Jednak kwasy furanokarboksylowe, nitrofurany i furfural mają grupy odciągające elektrony i nie reagują nawet z silnymi dienofilami. Może reagować z bezwodnikiem maleinowym , maleinianem i fumaranem pod wysokim ciśnieniem, akrylanem z katalizatorem ( jodkiem cynku ).
Całkowite uwodornienie furanu daje tetrahydrofuran (THF), rozpuszczalnik szeroko stosowany w chemii organicznej i farmaceutykach.
jako eterFuran to cykliczny eter . Jest szczególnie wrażliwy na otwory w kwaśnym środowisku wodnym. Jest to w szczególności źródło reakcji ubocznych, w szczególności pochodnych chlorowcowanych, które są szczególnie nietrwałe.
Regioselektywność podstawień
Pozycja, w której nastąpi podstawienie, zależy od stabilności półproduktu reakcji. Zapisanie form mezomerycznych związków pośrednich podstawienia elektrofilowego na furanie pokazuje, że podstawienie korzystnie przeprowadza się w pozycji 2 lub 5, ponieważ utworzony związek pośredni ma trzy formy mezomeryczne . Gdy podstawienie zachodzi w pozycji 3 lub 4, utworzony związek pośredni ma tylko dwie formy mezomeryczne i ma mniejszą stabilność.
Zapisywanie form mezomerycznych umożliwia zlokalizowanie częściowych ładunków ujemnych furanu w pozycjach 2, 3, 4 i 5. Spośród form mezomerycznych bardziej reprezentatywna jest forma nienaładowana, ponieważ jest bardziej stabilna. Wśród form mezomerycznych z ładunkami te, w których ładunki są najbardziej odległe, są bardziej reprezentatywne niż formy, w których ładunki są bliskie. Furan ma tylko jedną nienaładowaną postać mezomeryczną w przeciwieństwie do benzenu, który ma dwie nienaładowane formy mezomeryczne.
Reakcja z kwasami
Do kwasów mineralnych w roztworze wodnym rozcieńczonym, nie wpływają na zimno furan lub alkylfuranes. Ale po podgrzaniu protonują furan w pozycji 2, powodując otwarcie furanu i tworzenie związków dikarbonylowych. Ponadto silnie stężone kwasy ( kwas siarkowy , dymiący kwas azotowy ) czy kwasy Lewisa powodują polimeryzację furanu i jego pochodnych alkilowych.
Podstawniki furanowe wpływają na reaktywność z kwasami . Furany podstawione grupami odciągającymi elektrony są stosunkowo stabilne w środowisku kwaśnym, ponieważ pierścień jest mniej naładowany elektronicznie, a zatem mniej reaktywny. Z drugiej strony furany podstawione grupami będącymi donorami elektronów są łatwo otwierane lub polimeryzowane w środowisku kwaśnym. W rzeczywistości podstawniki będące donorami elektronów ułatwiają atak protonu w pozycji 2 furanu.
Aromatyczna substytucja nukleofilowa
Furan nie reaguje z odczynnikami nukleofilowymi. Jednak niektóre furany mające grupy odciągające elektrony mogą podlegać substytucji nukleofilowej tych grup.
Aromatyczna substytucja elektrofilowa
Furan jest bardziej reaktywny niż tiofen i benzen w stosunku do odczynników elektrofilowych, ale mniej reaktywny niż pirol .
Furan nitrowanie prowadzi się za pomocą bezwodnika octowego w H 3 C - CO - O - CO - CH 3i kwas azotowy HNO 3w niskiej temperaturze. Najpierw tworzy się 2-nitrofuran, a następnie, jeśli reakcja trwa, 2,5-dinitrofuran. Nitrowanie tworzy niearomatyczny, dający się wyodrębnić związek, który może stracić cząsteczkę kwasu octowego CH 3 COOHprzez działanie zasady, takiej jak pirydyna lub przez solwolizę .
Sulfonowania prowadzi się w temperaturze pokojowej przez działanie pirydyna - tritlenek siarki złożone z wytworzeniem związku soli monosulfonowanej.
Alkilacja w warunkach Friedela-Craftsa nie jest możliwa i prowadzi do powstania mieszaniny produktów i polimerów . Jednakże furan acylować w obecności kwasu Lewisa, z chlorków z kwasu lub bezwodnika . Podstawienie zachodzi w pozycji 2. Reakcja Vilsmeiera-Haacka umożliwia dodanie grupy formylowej w pozycji 2 furanu. Reakcja Mannicha nie działa z furanem, ale dotyczy alkilofuranów, które mają wolną pozycję 2 lub 5.
posługiwać się
Furan jest stosowany głównie jako prekursor w wysokowartościowych chemikaliach. W wyniku uwodornienia furanu można otrzymać tetrahydrofuran (THF) , który jest stosowany głównie jako rozpuszczalnik. Utlenianie w obecności bromu w metanolu daje 2,5-dimetoksy-2,5-dihydrofuran , stosowany w fotografii. Jest również prekursorem produktów fitosanitarnych, takich jak endothall .
Furan jest również używany jako blok do tworzenia polimerów, które są używane jako dodatki do środków czyszczących i proszków do prania. Zaletą takich dodatków jest to, że nie zawierają azotu ani fosforu.
Toksykologia
Substancje te mają charakter lipofilowy (rozpuszczają się w tłuszczach) i zanieczyszczają człowieka głównie przez przewód pokarmowy (w szczególności skażoną żywność).
Podczas ostrego zatrucia na twarzy i tułowiu występuje szczególny trądzik (chloracne). Dochodzi również do uszkodzenia nerwów obwodowych (mrowienie, ból dłoni lub stóp oraz zaburzenia odruchu miotatycznego). Opisano również hirsutyzm. Wreszcie znajdujemy uszkodzenia wątroby, cukru we krwi (cukrzyca) i metabolizm tłuszczów.
Wzrost zachorowań na nowotwory bez określonej lokalizacji jest znany i dotyczy głównie krwi (chłoniak, szpiczak), tkanek miękkich, płuc i wątroby.
Przepisy prawne
- W 2011 r. EFSA zaktualizował swoje dane dotyczące poziomów furanu w żywności. Jednak w chwili obecnej żadne przepisy nie określają maksymalnych dozwolonych poziomów w środkach spożywczych.
Wobec braku regulacji kapsułki kawy zostały niedawno zakwestionowane pod kątem obecności furanu. Jednak kilka działań, takich jak zapewnienie świeżego powietrza podczas prażenia nasion (lub mieszanie kawy łyżeczką), drastycznie zmniejsza poziom zanieczyszczenia.
Bibliografia
- (fr) R. Milcent, F. Chau Organic Heterocyclic Chemistry , EDP Sciences.
Zobacz też
Związki pokrewne strukturalnie lub chemicznie:
- Tetrahydrofuran , nasycony furan, szeroko stosowany jako rozpuszczalnik
-
Podstawione furany
- Furanoza , furan podstawiony przez grupy hydroksylowe
- Furfural , furan podstawiony grupą aldehydową
- Kwas furanowy, furan podstawiony grupą karboksylową
- Alkohol furfurylowy
-
Furany powiązane z cyklami
- Benzofuran , furan związany z benzenem
- Dibenzofuran , furan związany z dwoma benzenu
- Polichlorowany dibenzofuran
- Analogi furanu
Bibliografia
- FURANNE , bezpieczeństwo arkusz (-y) Międzynarodowego Programu na bezpieczeństwie Substancji Chemicznych , konsultowany w dniu 9 maja 2009
- (w) David R. Lide, Podręcznik chemii i fizyki , Boca Raton, CRC, 16 czerwca 2008, 89 th ed. , 2736 str. ( ISBN 978-1-4200-6679-1 i 1-4200-6679-X ) , str. 9-50
- (en) Yitzhak Marcus, Właściwości rozpuszczalników , t. 4, Anglia, John Wiley & Sons Ltd,1999, 239 pkt. ( ISBN 0-471-98369-1 )
- obliczona masa cząsteczkowa od „ atomowych jednostek masy elementów 2007 ” na www.chem.qmul.ac.uk .
- (en) ChemIDplus , " Furan - RN: 110-00-9 " , w chem.sis.nlm.nih.gov , US National Library of Medicine (dostęp 17 grudnia 2008 )
- (w) James E. Mark, Physical Properties of Polymer Handbook , Springer,2007, 2 II wyd. , 1076, s. ( ISBN 978-0-387-69002-5 i 0-387-69002-6 , czytaj online ) , str. 294
- (w) JG Speight, Norbert Adolph Lange, Lange's Handbook of Chemistry , McGraw-Hill,2005, 16 th ed. , 1623 s. ( ISBN 0-07-143220-5 ) , str. 2,289
- (en) Robert H. Perry i Donald W. Green , Perry's Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , str. 2-50
- „ Properties of Various Gases ” na stronie flexwareinc.com (dostęp 12 kwietnia 2010 )
- (w) Carl L. Yaws, Podręcznik diagramów termodynamicznych , t. 1, Huston, Teksas, Gulf Pub. Współ.,1996( ISBN 0-88415-857-8 )
- (w) David R. Lide, Podręcznik chemii i fizyki , Boca Raton, CRC,2008, 89 th ed. , 2736 str. ( ISBN 978-1-4200-6679-1 ) , str. 10-205
- Grupa robocza IARC ds. Oceny ryzyka rakotwórczego dla ludzi, „ Evaluations Globales de la Carcinogenicité pour l'Homme, Groupe 2B: potencjalnie rakotwórcze dla ludzi ” , na http://monographs.iarc.fr , IARC, 16 stycznia 2009(dostęp 22 sierpnia 2009 )
- Numer indeksu w tabeli 3.1 załącznika VI do rozporządzenia WE nr 1272/2008 (16 grudnia 2008)
- Wpis „Furan” w chemicznej bazie danych GESTIS IFA (niemieckiego organu odpowiedzialnego za bezpieczeństwo i higienę pracy) ( niemiecki , angielski ), dostęp 19 kwietnia 2011 (wymagany JavaScript)
- SIGMA-ALDRICH
- „ Furanne ” w bazie danych chemikaliów Reptox z CSST (Quebec organizacji odpowiedzialnej za bezpieczeństwo i higienę pracy), dostęp 25 kwietnia 2009
- "furan" , w ESIS , dostęp 17 lutego 2009
- (en) H.Limpricht, „ Ueber das tetraphenol C 4 H 4 O ” , Berichte der deutschen chemischen Gesellschaft , vol. 3, N O 1, 1870, s. 90-91 ( DOI 10.1002 / cber.18700030129 )
- (en) HE Hoydonckx, WM Van Rhijn, W. Van Rhijn, DE De Vos i PA Jacobs, „Furfural and Derivatives” , w Ullmann's Encyclopedia of Industrial Chemistry ,2007( podsumowanie )
- (in) Agency of Industrial Science and Technology , „ Research Information Database RIO-DB Home Page ” na http://riodb01.ibase.aist.go.jp , Tsukuba Advanced Computing Center (dostęp: 14 lipca 2008 )
- witryna chemii http://www.sciencelab.com/xMSDS-Furan-9927174
- Sigma, http://www.sigmaaldrich.com/catalog/ProductDetail.do?N4=185922%7CALDRICH&N5=SEARCH_CONCAT_PNO%7CBRAND_KEY&F=SPEC
- Heterocyklicznie chemii organicznej podstawowymi strukturami Rene Milcent, Francois Chau
- Witryna poświęcona heterochemii http://www.cem.msu.edu/~reusch/VirtualText/heterocy.htm
- (w) HR Kottke „Furan Derivatives” w „Kirk-Othmer Encyclopedia of Chemical Technology” 1998; John Wiley & Sons: Nowy Jork
- Dioksyny i furany. ED 5024. INRS. 2006
- EFSA 01/09/11 EFSA publikuje zaktualizowany raport na temat poziomów furanu w żywności
- MS Altaki, FJ Santos, MT Galceran, „Występowanie furanu w kawie z rynku hiszpańskiego: wkład parzenia i palenia”, Food Chemistry , 2011, 126 (4), 1527









