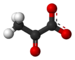
Kwas pirogronowy
| Kwas pirogronowy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Struktura kwasu pirogronowego |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nazwa IUPAC | Kwas 2-oksopropanowy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonimy |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O ECHA | 100,004,387 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O WE | 204-824-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 1060 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 2970 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| UŚMIECHY |
CC (= O) C (= O) O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
Std. InChI: InChI = 1S / C3H4O3 / c1-2 (4) 3 (5) 6 / h1H3, (H, 5,6) Stand. InChIKey: LCTONWCANYUPML-UHFFFAOYSA-N |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | bezbarwna ciecz | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości chemiczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formula |
C 3 H 4 O 3 [Izomery] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa cząsteczkowa | 88,0621 ± 0,0036 g / mol C 40,92%, H 4,58%, O 54,5%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 2.4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości fizyczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fuzja | 12 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * Temperatura wrzenia | 165 ° C (rozkład) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rozpuszczalność | rozpuszczalny w etanolu i eterze | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mieszalność | miesza się z wodą | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa objętościowa | 1,27 g · cm -3 do 20 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura zapłonu | 82 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochemia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
równanie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Środki ostrożności | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Niebezpieczeństwo H314, P280, P301 + P330 + P331, P305 + P351 + P338, P309 + P310, H314 : Powoduje poważne oparzenia skóry i uszkodzenia oczu P280 : Nosić rękawice ochronne / odzież ochronną / ochronę oczu / ochronę twarzy. P301 + P330 + P331 : W przypadku połknięcia: wypłukać usta. NIE prowokować wymiotów. P305 + P351 + P338 : W przypadku dostania się do oczu: Ostrożnie płukać wodą przez kilka minut. Zdejmij soczewki kontaktowe, jeśli ofiara je nosi i można je łatwo zdjąć. Kontynuuj płukanie. P309 + P311 : W przypadku narażenia lub złego samopoczucia: natychmiast skontaktować się z OŚRODKIEM ZATRUĆ lub lekarzem. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B3, E, B3 : Temperatura zapłonu cieczy palnej = 83,8 ° C w tyglu zamkniętym Metoda Setaflash E : Materiał silnie kwaśny żrący (obliczone pH = 1,8 dla roztworu 0,1 M) Wartość ujawnienia przy 1,0% zgodnie z kryteriami klasyfikacji |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
80 : żrący lub wykazujący niewielki stopień korozyjności Numer UN : 3265 : MATERIAŁ ŻRĄCY, KWASOWY, ORGANICZNY CIEKŁY, NSA Klasa: 8 Etykieta: 8 : Substancje żrące Opakowanie: Grupa pakowania III : substancje niskiego zagrożenia.  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekotoksykologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 | mysz, podskórnie: 3533 mg · kg -1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Związki pokrewne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jednostki SI i STP, chyba że określono inaczej. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Kwas pirogronowy jest związek chemiczny o wzorze CH 3 -CO-COOH. Jest to kwas 2-okso lub α- ketokwas , niosący zarówno funkcyjny kwas karboksylowy, jak i keton funkcyjny . Jego koniugatem jest anion pirogronianowy CH 3 -CO-COO -, A klucz metabolit się w styku z kilku głównych dróg metabolicznych w żywych komórkach , takich jak glikolizy , w cyklu Krebsa i glukoneogenezy i może być przekształcona w kwas tłuszczowy , alanina lub nawet etanolu po utleniającej dekarboksylacji do acetylo-koenzymu A .
Kwas pirogronowy
Kwas pirogronowy występuje w postaci bezbarwnej cieczy o zapachu zbliżonym do kwasu octowego . Jest mieszalny z wodą i rozpuszczalny w etanolu i eterze .
W laboratorium, kwas pirogronowy, można wytwarzać przez ogrzewanie mieszaniny kwasu winowego i wodorosiarczanu potasu , przez utlenianie z glikolu propylenowego z silnym utleniaczem (np Nadmanganian potasu lub podchlorynu sodu ), lub nawet przez hydrolizę 2-oxopropiononitrile , wytwarza się w reakcji od etanoil chlorku z cyjankiem potasu :
CH 3 COCl + KCN → CH 3 COCN CH 3 COCN → CH 3 COCOOHBiochemia pirogronianu
Opis
Jon pirogronianowy jest końcowym produktem szlaków degradacji glukozy ( glikoliza , szlak pentozofosforanowy , szlak Entner-Doudoroff ). To podłoże z fermentacji w stanie beztlenowym (fermentacja mlekowa), a cykl Krebsa pośrednio zapewnia tlenowych po Dekarboksylacja oksydacyjna przekształcenie go w acetylo-CoA .
Tworzenie pirogronianu przez glikolizę

|
+ ADP + H + ATP + |

|
| WERWA | Kwas pirogronowy | |
| Kinaza pirogronianowa - EC | ||
Fosfoenolopirogronian (PEP), utworzony podczas glikolizy ma fosforanową grupę z wysokim potencjałem przenoszenia - ΔG ° ' = -61,9 kJ mola -1 , najwyższa wartość zmierzoną u istot żywych - umożliwienie fosforylacji o cząsteczce od ADP do ATP przez pirogronianu kinaza . Do tej reakcji niezbędny jest kation Mg 2+ jako kofaktor .
Los pirogronianu w anaerobiozie
Następujące reakcje zachodzą w pożywce beztlenowej , w cytoplazmie , w mięśniu , w bakteriach kwasu mlekowego (do fermentacji mlekowej , na przykład w Lactobacillus ), a nawet w drożdżach (do fermentacji alkoholowej ). Możliwe są inne fermentacje , na przykład u Enterobacteriaceae (por. Szlaki fermentacyjne Enterobacteriaceae ).
Fermentacja mlekowa

|
+ NADH + H + → NAD + + |

|
| Kwas pirogronowy | Kwas mlekowy | |
| Dehydrogenaza L -mleczanowa - EC | ||
CH 3 -CHOH-COO - mleczanwytwarzany w mięśniu nie odpowiada za sztywność , wbrew powszechnemu przekonaniu, i nie ingeruje w zjawisko skurczów . Ponadto może być transportowany we krwi, a następnie w komórkach wątroby ( cykl Cory ).
Fermentacja alkoholowa- CH 3 -CO-COO -+ H + → CH 3 CHO+ CO 2przez dekarboksylazę pirogronianową w obecności pirofosforanu tiaminy (TPP).
- CH 3 CHO+ NADH + H + CH 3 CH 2 OH + NAD + , przez dehydrogenazę alkoholową .
Los pirogronianu w aerobiozie
W środowisku tlenowym pirogronian jest rozkładany w mitochondriach . Wnika przez translokazę pirogronianową . Możliwe są dwie reakcje, które generują prekursory cyklu Krebsa :
Oksydacyjna dekarboksylacja do acetylo-CoATa reakcja jest katalizowana przez kompleks multienzymatyczny, kompleks dehydrogenazy pirogronianowej , obejmujący pięć koenzymów :
- trzy koenzymy związane z apoenzymami : TPP , liponian i FAD (są to grupy prostetyczne );

|
+ NAD + + CoA-SH → CO 2+ NADH + H + + |
|
| Kwas pirogronowy | Acetylo-CoA | |
|
Kompleks dehydrogenazy pirogronianowej : dehydrogenaza pirogronianowa (E1) - EC S-acetylotransferaza dihydrolipoamidowa (E2) - EC dehydrogenaza dihydrolipoilowa (E3) - EC | ||
Ta reakcja zachodzi na poziomie ściany mitochondrialnej u eukariontów i na poziomie błony u prokariotów .
NADH + H + będzie następnie ponownie utlenia się z łańcucha oddechowego synonimem mitochondrialnego łańcucha transportu elektronów, w celu wytworzenia ATP tlenowej.
Karboksylacja do szczawiooctanuReakcja, katalizowana w obecności biotyny przez karboksylazę pirogronianową ( syntetazę ), daje szczawiooctan :

|
+ ATP + CO 2 → ADP + Pi + |
|
| Kwas pirogronowy | Kwas szczawiooctowy | |
| Karboksylaza pirogronianowa - EC | ||
Jest to poważna reakcja anaplerotyczna .
Porównawcza efektywność energetyczna
Z jednej cząsteczki glukozy , która daje dwie cząsteczki pirogronianu:
- fermentacje mają przeciętną wydajność: uwalniają tylko dwie cząsteczki ATP na cząsteczkę glukozy;
- degradacje tlenowe są znacznie bardziej opłacalne: każda cząsteczka glukozy pozwala na produkcję 14 cząsteczek ATP poprzez oksydacyjną dekarboksylację lub 6 cząsteczek ATP poprzez karboksylację, jeszcze przed degradacją acetylo-CoA w cyklu de Krebsa, który uwalnia jeszcze więcej energii.
Uwagi i odniesienia
- obliczona masa cząsteczkowa od „ atomowych jednostek masy elementów 2007 ” na www.chem.qmul.ac.uk .
- Wpis numeru CAS „127-17-3” do bazy danych chemikaliów GESTIS IFA (niemieckiego organu odpowiedzialnego za bezpieczeństwo i higienę pracy) ( niemiecki , angielski ), dostęp 03/08/09 (JavaScript wymagany)
- (w) Carl L. Yaws, Podręcznik diagramów termodynamicznych , t. 1, Huston, Teksas, Gulf Pub. Współ.,1996( ISBN 0-88415-857-8 )
- Wpis "Kwas pirogronowy" w chemicznej bazie danych GESTIS IFA (niemieckiego organu odpowiedzialnego za bezpieczeństwo i higienę pracy) ( niemiecki , angielski ), dostęp 6 stycznia 2019 r. (Wymagany JavaScript)
- „ kwas pirogronowy ” w bazie danych chemikaliów Reptox z CSST (Quebec organizacji odpowiedzialnej za bezpieczeństwo i higienę pracy), dostęp 24 kwietnia 2009
- Organic Syntheses, Coll. Lot. 1, str. 475 (1941); Lot. 4, str. 63 (1925). [1]
- Wienek, Sports Biology , s. 256, Vigot