Cyjanidyna
| Cyjanidyna | |
| Identyfikacja | |
|---|---|
| Nazwa IUPAC | 2-(3,4-dihydroksyfenylo)chromenylo-3,5,7-triol |
| N O CAS |
(chlorek) |
| PubChem | 128861 |
| UŚMIECH |
[o +] 1c (c (cc2c1cc (cc2O) O) O) c1cc (c (cc1) O) O , |
| InChI |
InChI: InChI = 1 / C15H10O6 / c16-8-4-11 (18) 9-6-13 (20) 15 (21-14 (9) 5-8) 7-1-2-10 (17) 12 (19) 3-7 / h1-6H, (H4-, 16,17,18,19,20) / p + 1 |
| Właściwości chemiczne | |
| Formuła |
C 15 H 11 O 6 [Izomery] |
| Masa cząsteczkowa | 287,2442 ± 0,0146 g / mol C 62,72%, H 3,86%, O 33,42%, |
| Jednostki SI i STP, chyba że zaznaczono inaczej. | |
Cyjanidyny lub cyanidol jest związek organiczny, naturalny w rodzinie anthocyanidols . Jest to stosunkowo niestabilny barwny pigment, który rzadko występuje w postaci wolnej w tkance roślinnej, ale raczej w bardziej stabilnej postaci glikozylowanej. Występuje w czerwonych owocach i czerwonych lub niebieskich płatkach wielu kwiatów.
W 1913 roku niemiecki chemik Richard Willstätter i jego współpracownicy opublikowali pierwsze badania nad pigmentami roślinnymi. Nazwali cyjanidynę pigmentu jagodowego po jego nazwie Centaurea cyanus .
Nieruchomości
Cyanidyna jest, obok delfinidyny , pelargonidyny , malwidyny , peonidyny i petunidyny , częścią głównych antocyjanidoli występujących w przyrodzie. W tej grupie charakteryzuje się obecnością dwóch grup hydroksylowych w pozycji 3 'i 4' pierścienia aromatycznego B (numeracja patrz tabela 2).
Ze względu na wysoką reaktywność jądra flavylium z nukleofilami , cyjanidol jest stosunkowo nietrwałą cząsteczką i rzadko występuje w postaci wolnej w tkankach roślinnych. Jego glikozylacja zapewnia lepszą stabilność i rozpuszczalność.
W tkankach roślinnych biosynteza heterozydu cyjandynowego , takiego jak cyjanidyno-3-glukozyd, zachodzi w szeregu etapów, z których każdy jest kontrolowany przez enzym kodowany przez jeden lub więcej genów. Zmutowane rośliny, które nie posiadają genu odpowiedzialnego za glikozylację cyjanidyny, nie akumulują cyjanidyny pomimo nienaruszonego szlaku biosyntezy antocyjanidolu. To wyraźnie wskazuje, że modyfikacja antocyjanidoli (przez glikozylację) jest konieczna do stabilnego przechowywania barwnych pigmentów.
Większość antocyjanozydów opiera się tylko na trzech antocyjanidolach: cyjanidyna stanowi 30%, delfinidyna 22%, a pelargonidyna 18%.
|
Tabela 1. Stężenie owoców i warzyw bogatych w cyjanidynę i jej heterozydowych pochodnych w mg/100 g s.m. | ||
| Cyjanidyna | ||
| Czerwona malina = 0,53 Rubus idaeus |
Truskawka = 0,50 Fragaria x ananassa |
Fasola zwyczajna = 1,63 czarna, cała, surowa, Phaseolus vulgaris |
| Niektóre heterozydy cyjanidowe | ||
| Cya-3 - glukozyd | Bzu = 794,13, Jeżyna ( Rubus ) = 138,72, Cassis = 25,07, Cherry słodki = 18,73 | |
| Cya-3 - galaktozyd | Aronia Czarna = 557,67, Żurawina Amerykańska = 8,89, Jabłko , Całość = 0,81 | |
| Cya-3-rutynozyd | Cassis = 160,78, Wiśnia słodka = 143,27, Śliwka świeża = 33,85 | |
| Cya-3,5-diglikozyd | Czarny bez = 17,46, Granat , czysty sok = 3,39 Fasola zwyczajna (czarna, cała, surowa) = 1,98 | |
| Cya-3-diglukozyd-5-glukozyd | Kapusta czerwona = 58 | |
Heterosydy cyjanidyny w żywności
Spośród 539 antocyjanozydów zidentyfikowanych przez Andersona i Jordheima (2006), 163 heterozydy cyjanidowe znajdują się w roślinach.
Wśród nich baza PENOL-EXPLORER wskazuje 19 najważniejszych występujących w żywności:
| Tabela 2. Heterozydy cyjanidynowe w żywności | |
| 3-O-glukozyd cyjanidyny | Czerwona malina, truskawka, żurawina amerykańska, czarna porzeczka, jeżyna, Vaccinium augustifolium, Vaccinium corymbosum, czerwona porzeczka, agrest, aronia czarna, czarny bez, czarne winogrono, brzoskwinia, czereśnia, wiśnia, śliwka, nektarynka, pomarańczowa krew, granat, zwykłe czarna fasola, oliwka, sałata |
| 3,5-O-diglikozyd cyjanidyny | czarny bez, granat |
| 3,5-O-glukozyd cyjanidyny | czerwona kapusta |
| Cyjanidyn 3-O- (6"-acetylo-galaktozyd) | Vaccinium augustifolium, Vaccinium corymbosum |
| Cyjanidyn 3-O- (6"-acetyloglukozyd) | Wino, Vaccinium augustifolium, Vaccinium corymbosum |
| Cyjanidyn 3-O- (6"-kafeoiloglukozyd) | Agrest ( Ribes uva-crispa ) |
| Cyjanidyn 3-O- (6"-dioksaliloglukozyd) | Jeżyna ( Rubus ) |
| Cyjanidyno 3-O- (6"-malonylo-3"-glukozylo-glukozyd) | czerwona cebula |
| Cyjanidyn 3-O- (6"-malonylo-glukozyd) | Jeżyna, czerwona pomarańcza, sałata, czerwona cebula |
| Cyjanidyn 3-O- (6"-p-kumaroilo-glukozyd) | Czarna porzeczka, Czarne winogrona, Agrest |
| Cyjanidyn 3-O- (6"-sukcynylo-glukozyd) | Truskawka |
| 3-O-arabinozyd cyjanidyny | Żurawina amerykańska, Vaccinium augustifolium, Vaccinium corymbosum , Aronia czarna, Jabłko |
| 3-O-galaktozyd cyjanidyny | Żurawina amerykańska, Vaccinium augustifolium, Vaccinium corymbosum , Aronia czarna, Jabłko |
| Cyjanidyno 3-O-glukozylo-rutynozyd | Czerwona malina, czarna porzeczka, wiśnia |
| 3-O-rutynozyd cyjanidyny | Czerwona malina, Czarna porzeczka, Jeżyna, Czerwona porzeczka, Agrest, Czarna surrealistyczna, Słodko-kwaśna wiśnia, Śliwka |
| 3-O-sambubiozyd cyjanidyny | Czerwona porzeczka, czarny bez |
| 3-O-sambubiozylo-5-O-glukozyd cyjanidyny | Czarny bez czarny |
| 3-O-soforozyd cyjanidyny | Czerwona malina, Czerwona porzeczka |
| 3-O-ksylozyd cyjanidyny | Jeżyna, Aronia, Jabłko |
| Cyjanidyno 3-O-ksylozylo-rutynozyd | Porzeczka |
Kolorowy pigment roślinny
Antocyjanozydy dostarczają naturalnych pigmentów, dla których nie wykryto toksyczności. Naturalny barwnik stosowany jako dodatek do żywności o kodzie E163a jest wytwarzany z heterozydów cyjandynowych . Jest to zwykle ekstrakcji z winogron moszczu . Ale ten barwnik jest niestabilny w środowisku wodnym: kolor zmienia się w zależności od pH, jest wrażliwy na ciepło, światło, siarczyny (często używane jako konserwanty) i metale (w puszkach).
- Chaber bławatek Centaurea cyanus
W 1913 r. niemiecki chemik Richard Willstätter, który w 1915 r. otrzymał Nagrodę Nobla za pionierską pracę nad pigmentami roślinnymi, dokonał zaskakującej obserwacji, że niebieski kolor chabrów i czerwony kolor róż pochodzi z tego samego antocyjanozydowego pigmentu. Przypisał tę zmienność koloru zmianie pH „płynu komórkowego”. Ale później, pomiar pH pożywki z wakuolami jagodowymi dał pH 4,6 (kwas), wartość odpowiadającą bezbarwnej postaci pigmentu (patrz antocyjany ). Mniej więcej w tym samym czasie w Japonii bracia Shibata wysunęli hipotezę, że niebieski kolor można uzyskać przez utworzenie kompleksu metalu (takiego jak Mg 2+ ) i antocyjanozydu. Teoria pH i teoria kompleksu metali, które mogły wydawać się rywalami, w rzeczywistości zawierają swoją część prawdy.
Po stu latach badania nad niebieskim pigmentem bławatków dopiero się zaczynają, aby odpowiedzieć na pytania Willstättera. Ten pigment, nazwany protocyjaniną , został po raz pierwszy wyizolowany przez Bayera w 1958 r., a następnie skrystalizowany przez Hayashi w 1961 r., który wykazał, że jest to związek metaloorganiczny o wysokiej masie cząsteczkowej złożony z żelaza, magnezu, antocyjanów, substancji podobnej do flawonoidów i cukrów. Dokładna struktura antocyjanozydu została opisana przez Takedę w 1983 jako dwukrotnie glikozylowana cyjanidyna [ 1 = cyjanidyno 3-O-(6-O-sukcynyloglukozyd)-5-O-glukozyd) ], nazwana centaurocyjaniną . Struktura związanego flawonoidu jest ko-pigmentem utworzonym przez acylowany glukozyd apigeniny [ 2 = apigenina 7-O-glukuronid-40-O-(6-O-malonyloglukozyd)].
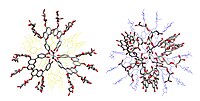
Protocyjaninę zrekonstruowano przez zmieszanie centaurocyjaniny 1 , malonyloflawonu 2 oraz jonów Fe i Mg. Wreszcie, próbując wyjaśnić, Takeda i jego współpracownicy w 2005 r. starali się zrekonstruować Protocyjaninę w laboratorium z jonów metali i związków 1 i 2 przygotowanych z oczyszczonej Protocyjaniny. Wykazali, że oprócz obecności żelaza i magnezu, obecność wapnia była niezbędna do uzyskania zrekonstruowanego pigmentu o takim samym widmie absorpcji w świetle widzialnym UV jak pigment naturalny. Wreszcie Shiono i in. (2005) opisują rentgenowską strukturę krystaliczną utworzoną z 6 cząsteczek antocyjanozydu 1 związanych z jonami Fe 3+ i Mg 2+ w środku, glikozydów 6 flawonów 2 związanych z dwoma jonami Ca 2+ . Kto by pomyślał, że splendor "Jagody lazuru, w wielkiej dojrzałej pszenicy" był wynikiem kaskady złożonych reakcji kontrolowanych przez baterię enzymów zakodowanych przez wiele genów tworzących piękną strukturę molekularną symetryczną tysiąca atomów (C 366 H 384 O 228 FeMg).
- Volibilis Ipomoea purpurea
Badanie zmienności barwy kwiatów Ipomoea purpurea volubilis wykazało dobrą korelację między barwą a składem antocyjanozydów. Jak większość pigmentów Convolvulaceae , mają one acylowaną soforozę (lub glukozę) w pozycji 3 (a czasami jednostkę glukozy w pozycji 5) cyjanidyny lub pelargonidyny . Soforozę , izomer sacharozy , jest wykonany z dwóch jednostek glukozy. Saito i wsp. wyizolowali sześć acylowanych glikozydów cyjandynowych z fioletowo-niebieskich kwiatów I. purpurea . Wszystkie te antocyjanozydy są oparte na 3-soforozydo-5-glukozydzie cyjanidyny acylowanym kwasem kawowym lub kumarowym . Ten sam zespół wyizolował również sześć antocyjanozydów zawierających w pozycji 3 soforozę (i w pozycji 5 pojedynczy hydroksyl OH) z czerwonobrązowych kwiatów I. purpurea . Zasadą jest 3-soforek cyjanidyny, a pozostałe pięć to pochodne acylowe kwasu kawowego i kwasu glukozylokawowego. Wreszcie fioletowo-czerwone kwiaty tego samego volubilis dały pelargonidynę 3-soforozyd-5-glukozyd.
Zmiana koloru podczas kwitnienia Ipomoea tricolor cv. „Niebiański błękit” to rzadki przypadek potwierdzający teorię pH. Pojedynczy pigment, triacylowany antocyjanozyd, odpowiada za purpurowy kolor pąków kwiatowych i jasnobłękitny błękit kwitnącego kwiatu. Jest to aktywny system transportu jonów Na + lub K + z cytozolu do wakuoli, który podczas otwierania kwiatów zwiększa pH wakuoli z 6,6 do 7,7. Słabo alkaliczny ośrodek wytwarza błękit płatków.
- Goździk zwyczajny Dianthus caryophyllus
Antocyjanozydy acylowane kwasem jabłkowym wyizolowano tylko z goździków. W goździku zwyczajnym Dianthus caryophyllus ciemnoróżowy i purpurowoczerwony wyizolowano 3,5-di-O-(b-glukopiranozylo)cyjanidyno-6"-O-4,6"-Ol-cykliczny jabłczan i jego odpowiednik z pelargonidyną. Kwas jabłkowy jest dwukwasem, który zamyka cykl, wiążąc się swoimi dwoma końcami z dwoma glukozami w pozycjach 3 i 5 cyjanidyny (lub pelargonidyny).
| Dianthus caryophyllus | R = cyjanidyna OH; R = H pelargonidyna Cy / Pel 3-O-(6-O-malylglukozyd)-5-O-glukozyd |
Działanie farmakologiczne
Cyjanidyna i jej pochodne mają właściwości przeciwutleniające i wymiatając wolne rodniki chronią komórki przed uszkodzeniami oksydacyjnymi oraz zmniejszają ryzyko uszkodzeń układu krążenia i niektórych nowotworów (patrz antocyjanozydy ). Spożywanie cyjanidyny może hamować rozwój otyłości i cukrzycy, a także ograniczać mechanizmy zapalne. Inne badania wykazały, że jego pochodna glukozydowa może odgrywać rolę w leczeniu raka.
Uwagi
- nie mylić z antocyjanami, które są ich glikozydami
- przykład strukturalny: cyjanidyno 3-O-[2-O-(6-O-(trans-3-O-(β-D-glukopiranozylo)kofeilo)-β-D-glukopiranozylo)-6-O-(trans- 4-O-(6-O-(trans-kofeilo)-β-D-glukopiranozylo)kofeilo)-β-D-glukopiranozyd]-5-O-[β-D-glukopiranozyd]
Bibliografia
- obliczona masa cząsteczkowa od „ atomowych jednostek masy elementów 2007 ” na www.chem.qmul.ac.uk .
- Bruneton J. farmakognozja - Phytochemistry, rośliny lecznicze, 4 p wydanie poprawione i powiększeniu. , Paryż, TEC & DOC - Międzynarodowy Medical Publishing,2009, 1288 s. ( ISBN 978-2-7430-1188-8 )
- P. Sarni-Manchado, V. Cheynier, Polifenole w przemyśle spożywczym , Lavoisier, Editions Tec & Doc,2006, 398 s. ( ISBN 2-7430-0805-9 )
- Keiko Yonekura-Sakakibara, Toru Nakayama, Mami Yamazaki i Kazuki Saito , „ Modyfikacja i stabilizacja antocyjanów ”, w Gould i in., Antocyjany, biosynteza, funkcje i zastosowania, Springer ,2009
- Oyvind M. Andersen (redaktor), Kenneth R. Markham (redaktor), Flavonoids: Chemistry, Biochemistry and Applications , CRC Press,2005, 1256 s.
- Oyvind Anderson, Monica Jordheim , „ Antocyjany ”, w „Flavonoids Chemistry, Biochemistry and Applications” red. Andersen, K. Markham, CRC ,2006
- FENOL-EX
- Wiesław Wiczkowski , Dorota Szawara-Nowak i Joanna Topolska , „ Antocyjany w czerwonej kapuście: profil, izolacja, identyfikacja i działanie przeciwutleniające ”, Food Research International , tom. 51, n o 1,2013, s. 303–309 ( DOI 10.1016 / j.foodres.2012.12.015 )
- Kosaku Takeda, Akiko Osakabe, Shinomi Saito, Daisuke Furuyama, Atsuko Tomita, Yumi Kojima, Mayumi Yamadera, Masaaki Sakuta , „ Składniki protocyjaniny, niebieski pigment z niebieskich kwiatów Centaurea cyanus ”, Fitochemia , tom. 66,2005
- Shiono M, Matsugaki N, Takeda K , „ Fitochemia: struktura barwnika z niebieskiego bławatka ”, „ Natura” , tom. 436 n O 7052,2005
- N Saito , „ Acylowane glikozydy cyjanidynowe w fioletowo-niebieskich kwiatach Ipomoea purpurea ”, Fitochemia , tom. 40, n o 4,Listopad 1995, s. 1283-1289 ( ISSN 0031-9422 , czytaj online , konsultacja 9 czerwca 2012 r. )
- Norio Saito, Fumi Tatsuzawa, Masato Yokoi, Kichiji Kasahara, Shigeru Iida, Atsushi Sh1gihara i Toshio Honda , „ Acylowane glikozydy pelargonidyny w czerwono-fioletowych kwiatach Ipomoea purpurea ”, Fitochemia , tom. 43, n o 6,1996
- Kumi Yoshida, Tadao Kondo, Yoshiji Okazaki & Kiyoshi Katou , „ Przyczyna koloru niebieskiego płatka ”, „ Natura” , tom. 373 N O 2911995
- Kumi Yoshida, Miki Kawachi, Mihoko Mori, Masayoshi Maeshima, Maki Kondo, Mikio Nishimura i Tadao Kondo , „ Zaangażowanie pomp protonowych Tonoplastu i wymienników Na + (K + )/H + w zmianę koloru płatków podczas otwierania kwiatów Morning Glory, Ipomoea tricolor cv. Heavenly Blue ”, Fizjol Komórek Roślinnych , tom. 46, n o 3,2005
- Masayoshi Nakayama, Masaji Koshioka, Hiroyuki Yoshida, Yukiko Kan, Yuko Fukui, Akira Koike, Masa-atsu Yamaguchi , „ Cykliczne antocyjany malilowe w Dianthus caryophyllus ”, Fitochemia , tom. 55,2000, s. 937-939
- Joana Azevedo, Iva Fernandes, Ana Faria, Joana Oliveira, Ana Fernandes, Victor de Freitas, Nuno Mateus , „ Właściwości przeciwutleniające antocyjanidyn, antocyjanidyno-3-glukozydy i odpowiednie portyzyny ”, Chemia żywności , tom. 119,2010, s. 518-523
- Pamela J Mink, Carolyn G Scrafford, Leila M Barraj, Lisa Harnack, Ching-Ping Hong, Jennifer A Nettleton i David R Jacobs Jr , „ Spożycie flawonoidów i śmiertelność z powodu chorób układu krążenia: prospektywne badanie u kobiet po menopauzie ”, Am. J Clin. Nutr. , tom. 85,2007, s. 895-909
- Sasaki R, Nishimura N, Hoshino H, Isa Y, Kadowaki M, Ichi T, Tanaka A, Nishiumi S, Fukuda I, Ashida H, Horio F, Tsuda T. 3-glukozyd cyjanidyny łagodzi hiperglikemię i wrażliwość na insulinę z powodu obniżenia Ekspresja białka wiążącego retinol 4 u myszy z cukrzycą. Biochem Pharmacol. 3 grudnia 2007; 74 (11): 1619-27. [1]
- (en) Fimognari C, Berti F, Nusse M, Cantelli Forti G, Hrelia P, " Aktywność przeciwnowotworowa cyjanidyno-3-O-beta-glukopiranozydu in vitro " , Chemioterapia , tom. 51, n o 6,2005, s. 332-5 ( PMID 16224184 , DOI 10.1159 / 000088956 )
- (w) Chen PN Chu SC, Chiou HL, Kuo WH Chiang CL Hsieh YS, „ Antocyjany morwy, 3-rutynozyd cyjanidyny i 3-glukozyd cyjanidyny, WYSTAWIONE roczne działanie hamujące na migrację i inwazję ludzkiej linii komórkowej raka płuc ” , Rak Lett. , tom. 235 n O 22006, s. 248–59 ( PMID 15975709 , DOI 10.1016 / j.canlet.2005.04.033 )
- Tulio AZ Jr, Reese RN, Wyzgoski FJ, Rinaldi PL, Fu R, Scheerens JC, Miller AR. 3-rutynozyd cyjanidyny i 3-ksylosylrutynozyd cyjanidyny jako główne przeciwutleniacze fenolowe w malinach czarnych. J Agric Food Chem. 26 marca 2008; 56 (6): 1880-8. [2]