Kwas glutaminowy
| Kwas glutaminowy | |
 L lub S (+) kwasu - glutaminowy ( biologicznego enancjomeru ), D lub R (-) kwasu - glutaminowy 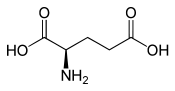 |
|
| Identyfikacja | |
|---|---|
| Nazwa IUPAC | Kwas 2-aminopentanodiowy |
| Synonimy |
E, |
| N O CAS |
(racemiczny) (D) lubR(-) (L) lubS(+) |
| N O ECHA | 100,009,567 |
| N O WE | 200-293-7 |
| Kod ATC | A09 |
| PubChem | 33032 |
| ChEBI | 18237 |
| N o E | E620 |
| FEMA | 3285 |
| UŚMIECHY |
OC (= O) CCC (N) C (= O) O , |
| InChI |
InChI: InChI = 1 / C5H9NO4 / c6-3 (5 (9) 10) 1-2-4 (7) 8 / h3H, 1-2,6H2, (H, 7,8) (H, 9, 10) InChIKey : WHUUTDBJXJRKMK-UHFFFAOYAD Std. InChI: InChI = 1S / C5H9NO4 / c6-3 (5 (9) 10) 1-2-4 (7) 8 / h3H, 1-2,6H2, (H, 7,8) (H, 9, 10) Std . InChIKey: WHUUTDBJXJRKMK-UHFFFAOYSA-N |
| Właściwości chemiczne | |
| Brute formula |
C 5 H 9 N O 4 [Izomery] |
| Masa cząsteczkowa | 147,1293 ± 0,006 g / mol C 40,82%, H 6,17%, N 9,52%, O 43,5%, |
| pKa | 2,19 4,25 9,67 |
| Właściwości fizyczne | |
| T ° fuzja | 247 ° C do 249 ° C, |
| Rozpuszczalność | Trudno rozpuszczalny w etanolu |
| Masa objętościowa | 1,538 |
| Właściwości biochemiczne | |
| Kodony | GAA, GAG |
| izoelektryczne pH | 3.22 |
| Niezbędny aminokwas | W zależności od przypadku |
| Występowanie u kręgowców | 5,8% |
| Środki ostrożności | |
| WHMIS | |
|
Produkt niekontrolowanyTen produkt nie jest objęty kontrolą zgodnie z kryteriami klasyfikacji WHMIS. |
|
| Jednostki SI i STP, chyba że określono inaczej. | |
Kwas glutaminowy (Skróty IUPAC - IUBMB : Glu i e ) lub glutaminian postaci anionowego kwasu glutaminowego jest kwaśny α-aminokwas, którego enancjomer L jest jednym z 22 tworzących białka aminokwasów , kodowanych w informacyjnych RNA przez kodonów GAA i gag. Charakteryzuje się obecnością grupy karboksylowej –COOH na końcu łańcucha bocznego , co czyni go ujemnie naładowaną resztą kwasową w białkach . Jego promień van der Waalsa wynosi 2,109 Å . To nie jest istotne dla ludzi , ale w niektórych przypadkach może być produkowane w ilościach niewystarczających przez organizm, wymagających w diecie spożycie .
Kwas glutaminowy odgrywa kluczową rolę dla własnej funkcji komórkowej, ale nie jest uważany za niezbędny składnik odżywczy u ludzi, ponieważ organizm może go wytworzyć z prostszych związków, takich jak transaminacja α-ketoglutaranu, produktu pośredniego utleniania cukrów prostych w mitochondria ( cykl Krebsa ).
Glutaminian, zjonizowana forma kwasu glutaminowego, jest najważniejszym pobudzającym neuroprzekaźnikiem w ośrodkowym układzie nerwowym . Jego działanie jest równoważone hamującym działaniem GABA, którego jest również głównym prekursorem.
Używany jako wzmacniacz smaku, ponieważ odpowiada za smak umami w postaci soli sodowej ( glutaminianu sodu lub glutaminianu sodu), generalnie nie jest uważany za toksyczny. Rzeczywiście, nie przechodzi przez barierę krew-mózg, ponieważ jest zbyt hydrofilowy. Glutaminian w wysokich stężeniach i przy długotrwałym stosowaniu ma dobrze udokumentowaną toksyczność, pomimo kontrastujących wyników. Jego przewlekłe stosowanie jest oskarżane o wywoływanie efektów neurotoksycznych i uszkodzenia nerek przy nadmiernych stężeniach, bez dokładnego wyjaśnienia tych elementów.
Kiedy równowaga jest zachwiana, a stężenie glutaminianu osiąga nadmierny poziom w szczelinie synaptycznej lub gdy pozostaje zbyt długo w tej szczelinie, może hiperstymulować neurony i spowodować ich śmierć.
Neurotransmitter
Kwas glutaminowy jest nie tylko jednym z bloków budulcowych wykorzystywanych do biosyntezy białek , ale także najbardziej rozpowszechnionym neuroprzekaźnikiem pobudzającym w ośrodkowym układzie nerwowym (mózg + rdzeń kręgowy) oraz prekursorem GABA w neuronach GABAergicznych. Byłby mediatorem prawie 50% neuronów centralnych. Jest głównym neuroprzekaźnikiem pobudzającym neuronów piramidalnych, neuronów projekcyjnych występujących w połączeniach korowo-okrężnicowych i korowo-wzgórzowych.
Glutaminian aktywuje receptory jonotropowe AMPA , NMDA i kainate KAR, a także receptory metabotropowe . Sam kwas glutaminowy nie przenika słabo przez barierę krew-mózg , chyba że został przekształcony w L- glutaminę, która może być wykorzystywana przez mózg jako paliwo komórkowe i do syntezy białek lub do tworzenia presynaptycznych zapasów glutaminianu.
Glutaminian powstaje w mitochondriach neuronów na dwa sposoby: albo przez transaminację alfa-ketoglutaranu (metabolitu mitochondrialnego cyklu Krebsa ), albo przez oksydacyjną deaminację glutaminy przez enzym glutaminazę. Następnie jest przechowywany w pęcherzykach neuronów glutaminergicznych.
Kiedy potencjał czynnościowy dociera do końca aksonu , pęcherzyki egzocytarnie uwalniają swój glutaminian do szczeliny synaptycznej.
Glutaminian wiąże się następnie z różnymi receptorami postsynaptycznymi. Kanały receptorowe, NMDA, AMPA i KAR (lub receptory jonotropowe) wpuszczają kationy (Na + , K + , Ca 2+ ). Wprowadzenie ładunków dodatnich aktywuje bramkowane napięciem kanały sodowe, które inicjują rozładowanie potencjału czynnościowego.
Te receptory sprzężone z białkami G , aby mglu8 mGlu1 (lub receptorów metabotropowych) pośrednio Aktywacja kanałów jonowych przez kaskadę reakcji z udziałem proteiny G . Interwencja tych licznych pośredników spowalnia przetwarzanie informacji, ale umożliwia wielokrotne aktywacje.
W szczelinie synaptycznej glutaminian nie jest metabolizowany. Cząsteczki, które nie są wychwytywane przez receptory postsynaptyczne, są następnie wychwytywane głównie przez sąsiednie komórki glejowe i metabolizowane do glutaminy :
Glutaminian + ATP + NH 3 → Glutamina + ADP + fosforan
Glutamina jest następnie eksportowana do środowiska zewnątrzkomórkowego, gdzie zostanie wychwycona przez neurony glutaminergiczne. Ten dwukomórkowy recykling nazywany jest cyklem glutaminianowo-glutaminowym .
Receptory jonotropowe dla glutaminianu, NMDA, AMPA, KAR
Te kanały receptorowe składają się z połączenia różnych podjednostek, ogólnie w postaci tetramerów. Te podjednostki są białkami transbłonowymi kodowanymi przez geny podane w poniższej tabeli. Ta różnorodność byłaby dodatkowo zwiększona przez alternatywne splatanie kilku podjednostek.
| Rodzina odbiorników | Podjednostka | Niewygodny | Chromosom (człowiek) |
|---|---|---|---|
| NMDA | NR1 | GRIN1 | 9q34.3 |
| NR2A | GRIN2A | 16p13.2 | |
| NR2B | GRIN2B | 12p12 | |
| NR2C | GRIN2C | 17q24-q25 | |
| NR2D | GRIN2D | 19q13.1qter | |
| NR3A | GRIN3A | 9q31.1 | |
| NR3B | GRIN3B | 19p13.3 | |
| AMPA | KLEJ 1 | GRIA1 | 5q33 |
| KLEJ 2 | GRIA2 | 4q32-33 | |
| KLEJ 3 | GRIA3 | Xq25-26 | |
| KLEJ 4 | GRIA4 | 11q22-23 | |
| KAR | KLEJ 5 | GRIK1 | 21q21.1-22.1 |
| KLEJ 6 | GRIK2 | 6q16.3-q21 | |
| KLEJ 7 | GRIK3 | 1p34-p33 | |
| KA-1 | GRIK4 | 11q22.3 | |
| KA-2 | GRIK5 | 19q13.2 |
Wszystkie podjednostki jonotropowego receptora glutaminianu mają wewnątrzkomórkowy C-koniec i 3 transbłonowe helisy.
Receptory NMDA to tetramery, utworzone z dwóch podjednostek NR1 i dwóch podjednostek NR2 (NR2A, NR2B, NR2C lub NR2D). Podjednostki NR1 są obowiązkowe, natomiast podjednostki NR2 określają właściwości elektrofizjologiczne receptorów NMDA, takie jak wrażliwość na glutaminian, przepuszczalność wapnia, hamowanie magnezu. Podjednostki NR3 A i B mają hamujący wpływ na aktywność receptora.
L-glutaminian wiąże się z końcem N podjednostek NR2A i NR2B receptora NMDA . Aby go aktywować, glicyna musi również związać się z NR1. Jest koagonistą glutaminianu. Wiązanie się glutaminianu z domeną zewnątrzkomórkową powoduje zmianę konformacji podjednostek i stopniowe otwieranie porów.
Kilka cząsteczek jest również zdolnych do modulowania aktywności receptorów NMDA. Tak jest w przypadku jonów magnezu Mg 2+ , które wiążą się z miejscami zlokalizowanymi w kanale jonowym i je blokują. Depolaryzacja błony indukowana aktywacją receptorów AMPA pozwala na wyparcie tych jonów i usunięcie blokady.
Te receptory NMDA są szeroko rozmieszczone w całym układzie nerwowym, zazwyczaj w jednej lokalizacji, z receptorów AMPA. Są bardzo liczne w przodomózgowiu z dużą gęstością w rejonie CA1 hipokampu .
Stymulacja receptorów postsynaptycznych generuje pobudzające potencjały postsynaptyczne . Towarzyszy temu w pozycji wapnia , powodując pobudzenie kinaza białkowa aktywowana przez parę wapnia kalmoduliny CAM kinazy 2 , zaangażowane w zjawisku długotrwałego wzmocnienia (LTP długoterminowe wzmaganie ). To zjawisko LTP leży u podstaw procesu uczenia się i zapamiętywania .
Nadmierne wchłanianie wapnia przez hiperstymulację receptorów NMDA może powodować śmierć neuronów w wyniku apoptozy, która byłaby zaangażowana w neurodegenerację obserwowaną w chorobie Parkinsona , chorobie Alzheimera i udarach niedokrwiennych.
Aktywacja receptorów AMPA wyzwala otwarcie kanału przepuszczalnego dla potasu i sodu. W ten sposób potas wydostanie się z komórki, a sód wejdzie do niej. W niektórych przypadkach występuje dodatek wapnia, w zależności od struktury AMPA (w szczególności od obecności lub nie edytowanej podjednostki GluR2). W ten sposób pozwoli na depolaryzację błony docelowego neuronu glutaminianu.
W kainianu receptorów KAR są na ogół umieszczone na presynaptycznych i glutaminergicznego synaps lub GABAergicznego. Występuje głównie w hipokampie i warstwach podkrasznikowych kory mózgowej. Presynaptyczne receptory KAR są hamowane przez aktywację trimerycznych białek G Gi i Gq, które zmniejszają egzocytozę glutaminianu lub GABA. Istnieją również pobudzające postsynaptyczne receptory KAR.
Receptory metabotropowe, mglu
Metabotropowego receptora glutaminianu w formie homodimerów połączone mostkami disiarczkowymi .
Te mGlu receptory są umieszczone na neurony w ośrodkowym układzie nerwowym i komórek glejowych .
Receptory postsynaptyczne mglu1 i mglu5 uczestniczą w zjawisku długotrwałego wzmocnienia . Mglu1 występują obficie w hipokampie i wzgórzu . Mglu5 znajdują się w korze mózgowej, prążkowiu brzusznym i częściach hipokampu, migdałków mózgowych i wzgórzu. Te dwa receptory są sprzężone z białkami Gq i fosfolipazami C, przy czym ta ostatnia katalizuje tworzenie diacyloglicerolu (DAG) i trifosforanu inozytolu (IP3). DAG jest kinaza białkowa C aktywator . IP3 wiąże się ze swoim receptorem zlokalizowanym w siateczce endoplazmatycznej i umożliwia uwolnienie wapnia z siateczki do cytoplazmy .
Receptor mglu6, również obecny na poziomie postsynaptycznym , powoduje powolną depolaryzację .
Receptory mglu2, 3, 4, 7 i 8 są presynaptyczne i powodują zmniejszone uwalnianie glutaminianu.
Role
Uważa się, że glutaminian odgrywa rolę w uczeniu się mózgu i funkcjach zapamiętywania . Jest to rzeczywiście neuroprzekaźnik o dużym znaczeniu. Brak równowagi w jej funkcjonowaniu, głównie w kontekście odurzenia ( ketamina , LSD ), może powodować efekty patologiczne, takie jak występujące w stwardnieniu zanikowym bocznym , chorobie Alzheimera , limfatyzmie .
Psychotropowe fencyklidyny (znany jako PCP lub anioł proszku ) jest niekonkurencyjny inhibitor glutaminianu na receptorze NMDA przez stabilizację kanałów jonowych tych receptorów w stanie otwartym. Powoduje zachowania podobne do schizofrenii . Z drugiej strony, dawki ketaminy , antagonisty receptora NMDA, niższe niż stosowane w anestezjologii, powodują efekty dysocjacyjne i halucynacje .
Działanie glutaminianów jest bardzo trudne do zbadania ze względu na jego efemeryczny charakter. Zespół z Uniwersytetu Stanforda opracował nanodetektor białek do obserwacji neuronalnej produkcji glutaminianu za pomocą fluorescencji / luminescencji .
Ten detektor, białko , ma parę płatów połączonych przegubowo wokół zawiasu, jak pułapka na muchołówki mięsożernej Dionaea . Kiedy glutaminian wiąże się z białkami, płaty zamykają się. Do detektora przymocowane są dwa białka fluorescencyjne , wyekstrahowane z meduzy . Jedna z nich emituje niebieską luminescencję, która wzbudza drugą, która z kolei emituje żółtą luminescencję. Gdy płatki zamykają się na glutaminianu, niebieskie białko oddala się od żółtego, zmniejszając intensywność luminescencji. To zmniejsza sygnały, że glutaminian opuścił neuron . W tej chwili detektor ten może znajdować się tylko na powierzchni komórki : może zatem wskazywać jedynie obecność glutaminianu na zewnątrz komórki.
Możemy za pomocą ultrafioletu wywołać uwolnienie określonej formy glutaminianu (glutaminian w klatkach, „glutaminian w klatkach”, po stymulacji UV, glutaminian jest aktywny, „glutaminian nieskondensowany”) w wybranym miejscu jednego lub więcej neuronów. Wykazano, że ta metoda fotostymulacji jest bardzo skuteczna w mapowaniu połączeń międzyneuronalnych.
Glutaminian sodu jest stosowany w eksperymentach do wywoływania otyłości u szczurów w celach eksperymentalnych, takich jak określenie mechanizmów otyłości.
Neurotoksyczność
W nadmiernych stężeniach w mózgu glutaminian wyzwala proces zwany ekscytotoksycznością , szkodliwy, a nawet śmiertelny dla neuronów, szczególnie w przypadku aktywacji receptorów NMDA .
Jego toksyczność można powiązać z:
- nadmierny i niekontrolowany napływ Ca 2+ do komórki, przekraczający jej pojemność magazynową. Następują zmiany mitochondrialne , prowadzące do uwolnienia cytochromu p450 , co prowadzi do apoptozy ;
- nadekspresja czynników transkrypcyjnych genów proapoptotycznych lub represja czynników przeciwapoptotycznych, za pośrednictwem glutaminianu i wapnia.
Teorie te opierają się na pośmiertnych obserwacjach neurodegeneracji u znanych pacjentów z padaczką .
Atak epilepsji
Glutaminian jest powiązany z napadami padaczki , biorąc pod uwagę błyskawicę depolaryzacji ( sekundę ), którą wywołuje in vitro przez mikroiniekcję do neuronu, co odtwarza zjawisko depolaryzacji, przesunięcie depolaryzacji napadowej obserwowane w EEG podczas kryzysu in vivo.
Sugerowanym mechanizmem jest obniżenie potencjału spoczynkowego błony na poziomie ogniska padaczkowego, co spowodowałoby otwarcie kanałów zależnych od napięcia, powodując napływ glutaminianu, który utrzymywałby depolaryzację.
Wolny glutaminian naturalnie obecny w żywności
Kwas glutaminowy jest aminokwasem bardzo powszechnym, występującym w wielu białkach roślinnych i zwierzęcych. To nawet najbardziej obfity aminokwas w diecie człowieka. Jego specyficzny smak jest wykrywalny tylko wtedy, gdy występuje w stanie wolnym. Ten smak, różniący się od słodkiego, słonego, kwaśnego i gorzkiego, został po raz pierwszy rozpoznany w 1908 roku przez japońskiego naukowca Kikunae Ikeda, który nazwał go umami ( smaczny ).
Jako składnik białek glutaminian pozostaje bez smaku, ale może wyrazić swój pełny smak poprzez uwolnienie poprzez hydrolizę białek podczas procesów fermentacji , leżakowania, dojrzewania czy gotowania produktów spożywczych.
Wolny kwas glutaminowy występuje naturalnie w serach, takich jak parmezan , sos sojowy czy pomidory. To on odgrywa fundamentalną rolę w smaku serów, bulionów ze skorupiaków i mięs. Oto główne pomiary wykonane przez Kumiko Ninomiya (1998):
| Wolny glutaminian w żywności (po Ninomiya 1998) | ||
| Klasa | Artykuły spożywcze | Wolny glutaminian (mg / 100 g ) |
|---|---|---|
| Ser | ser parmezan | 1,680 |
| Emmental | 308 | |
| Glony | Wodorosty morskie | 1,608 |
| Wakame ( Undaria ) | 9 | |
| Sos sojowy | chiński | 926 |
| język japoński | 782 | |
| koreański | 1,264 | |
| Rośliny | Pomidor | 246 |
| Groch | 106 | |
| Kapusta | 50 | |
| Mięsa | Wołowina | 10 |
| kurczak | 22 | |
| Skorupiak | Przegrzebek | 140 |
| Krab królewski | 72 | |
W niektórych pokarmach glutaminian może występować w bardzo dużej ilości w postaci związanej i być częściowo uwalniany podczas przygotowywania posiłków. Oto kilka starszych miar Giacomettiego (1979):
|
Związany lub wolny glutaminian w żywności, w mg / 100 g (według Giacometti 1979) | |||
| Klasa | Artykuły spożywcze | Związany glutaminian | Wolny glutaminian |
|---|---|---|---|
| Ryba | Dorsz | 2 101, | 9 |
| łosoś | 2,216 | 36 | |
| Rośliny | Groch | 5,583 | 200 |
| Pomidory | 238 | 140 | |
| Nabiał | Krowie mleko | 819 | 2 |
| ser parmezan | 9,847 | 1200 | |
| Mięsa | kurczak | 3 309, | 44 |
| Wołowina | 2,846 | 33 | |
Glutaminian, dodatek do żywności
Zgodnie z kodem E620 glutaminian jest stosowany jako wzmacniacz smaku w żywności. Dodawany jest do przetworów spożywczych w celu wzmocnienia ich smaku.
Oprócz glutaminianu, Codex Alimentarius uznał również za wzmacniacze smaku jego sole sodowe (E621), potasowe (E622), wapniowe (E623), amonowe (E624) i magnezowe (E625):
| n O | Opis |
|---|---|
| E620 | Kwas glutaminowy |
| E621 | Glutaminian sodu , MSG |
| E622 | Glutaminian monopotasu |
| E623 | Diglutaminian wapnia |
| E624 | Glutaminian amonu |
| E625 | Diglutaminian magnezu |
Glutaminian monosodowy (MSG), soli sodowej kwasu glutaminowego, nadaje smak podobny do tego aminokwasu z korzyścią zawierające trzy razy mniej niż sód soli kuchennej .
Glutaminian (lub jego sole) często występuje w gotowych posiłkach (zupach, sosach, chipsach, gotowych daniach). Jest również powszechnie stosowany w kuchni azjatyckiej.
Obecnie jest często stosowany w połączeniu ze smakami w aperitifach (smak boczku, smak sera). Pomaga to poprawić smak boczku, sera itp. Rzadko można znaleźć aperitif, który go nie zawiera. Występuje również w niektórych kapsułkach leków, ale nie ze względu na jego funkcje smakowe. Wreszcie, jest to większość składników pomocniczych do gotowania (kostki rosołowe, bazy do sosów, sosy, itp.) Powszechnie stosowana w dystrybucji masowej, niektóre „organiczne” środki pomocnicze zawierają znacznie mniej lub wcale.
Poprawiony smak i dieta
Badania wykazały, że dodatek glutaminianu sodu (MSG) zwiększa smakowitość pożywienia i pobudza apetyt (Belliste 1998, Yamaguchi et al. 2000). Efekt ten jest bardziej widoczny u dzieci i dorosłych niż u osób starszych. Podczas degustacji potraw o różnych stężeniach glutaminianu sodu obserwuje się, że niektóre nie są ulepszone (jak produkty słodkie), a inne mają optymalne preferowane stężenie. To optymalne stężenie różni się w zależności od osoby. Według badań F. Bellisle'a preferowane stężenie Europejczyków (mieszczące się w przedziale od 0,6 do 1,2%) jest zwykle wyższe niż u Azjatów. Ogólnie przyprawa glutaminianowa dobrze sprawdza się w przypadku produktów słonych i kwaśnych. Zalecana przez Jinapa i Hajeba dawka do dodania to 0,5 do 4 g na 500 g pokarmu, czyli bardzo mało (0,1 do 0,8%), ponieważ nadmiar szybko psuje smak.
Czy dodatek glutaminianu sodu do żywności, poprawiając jej smak, nie grozi jej nadmiernym spożyciem, co może prowadzić do przybierania na wadze? Hipoteza ta została sprawdzona w grupie osób starszych (średnio 84 lata) mieszkających przez rok w wyspecjalizowanych domach. Dodatek glutaminianu sodu do pożywienia interesującego pod względem odżywczym (zup, warzyw, produktów bogatych w skrobię) doprowadził do wzrostu ich spożycia. Jednak całkowita wielkość spożycia żywności nie uległa zmianie, ponieważ zwiększone spożycie produktów o smaku glutaminianowym zostało zrekompensowane zmniejszonym spożyciem posiłków podawanych później, takich jak słodkie desery. Ta sama obserwacja dotyczy hospitalizowanych chorych na cukrzycę. Ponownie, pacjenci spontanicznie spożywali więcej zalecanych produktów przyprawionych glutaminianem i mniej innych produktów, co nie zmieniało ogólnego spożycia energii w posiłkach. Dlatego dodatek glutaminianu sodu umożliwia zmianę orientacji wyborów żywieniowych.
„Syndrom chińskiej restauracji”
Zgłoszono kilka przypadków nietolerancji glutaminianu sodu, ale żadne badania nie wykazały rozstrzygającego związku między glutaminianem sodu a nietolerancjami.
Ogólnie rzecz biorąc, glutaminian sodu od dawna jest opisywany jako odpowiedzialny za „syndrom chińskiej restauracji”, ponieważ kuchnia azjatycka jest bardzo bogata w glutaminian. W przypadku wystąpienia reakcji pierwszym objawem jest zaczerwienienie (intensywne i przejściowe czerwone zabarwienie twarzy, szyi i tułowia). Mogą również pojawić się: przekrwione oczy, bóle głowy, uczucie pieczenia występujące w tułowiu i promieniujące do obwodów, uczucie ucisku w klatce piersiowej , pieczenie głowy, uderzenia gorąca, nudności i wymioty, uczucie duszenia, trudności w oddychaniu, uczucie dyskomfortu ...
Ten stan występuje od kwadransa do pół godziny po spożyciu i może trwać do dwóch godzin. Siła tej reakcji niekoniecznie jest proporcjonalna do spożytej dawki, wystarczy kilka miligramów. Jego bezpośredni związek z przyjmowaniem glutaminianu nie został naukowo udowodniony. Około jedna na 5000 osób byłaby wrażliwa na jego spożycie, ale co dziwne, jedna na 50 000 w krajach azjatyckich.
Randomizowane, podwójnie ślepe, kontrolowane placebo badanie przeprowadzone wspólnie przez cztery główne amerykańskie uniwersytety, opublikowane w 2000 roku i badające potencjalne skutki spożycia glutaminianu, nie potwierdziło wpływu glutaminianu na „syndrom” Chińczyków restauracja ”.
Wiele pokarmów stosowanych w kuchni zachodniej jest naturalnie bogatych w wolny glutaminian, takich jak parmezan ( 1200 mg / 100 g ), roquefort ( 1280 mg / 100 g ), pomidor ( 140 mg / 100 g ), ziemia jabłkowa (od 30 do 100 mg) / 100 g ), groszek ( 200 mg / 100 g ) i większość owoców morza Nie są znane jako wywołujące objawy syndromu chińskiej restauracji. Posiłek w chińskiej restauracji może zawierać od 10 do 1500 mg glutaminianu na 100 g .
Uwagi i odniesienia
- obliczona masa cząsteczkowa od „ atomowych jednostek masy elementów 2007 ” na www.chem.qmul.ac.uk .
- (w) Francis A. Carey, „ Tabela PK i wartościach pH ” , w Wydziału Chemii na Uniwersytecie w Calgary , 2014(dostęp 26 lipca 2015 )
- (w) Mr. Beals, L. Gross, S. Harrell, " Amino Acid Frequency " on The Institute for Environmental Modeling (ITSH) to the University of Tennessee (dostęp: 26 lipca 2015 )
- „ kwas glutaminowy (l) ” w bazie danych chemikaliów Reptox z CSST (Quebec organizacji odpowiedzialnej za bezpieczeństwo i higienę pracy), dostęp 23 kwietnia 2009
- Matthew Freeman , „ Reconsecting the effects of glutaminate monosodium glutaminate: przegląd literatury ”, Journal of the American Academy of Nurse Practitioners , vol. 18 N O 10,Październik 2006, s. 482–486 ( ISSN 1041-2972 , PMID 16999713 , DOI 10.1111 / j.1745-7599.2006.00160.x , czytaj online , dostęp 18 grudnia 2017 )
- H. N. Mallick , „ Understanding safety of glutaminate in food and brain ”, Indian Journal of Physiology and Pharmacology , tom. 51, n o 3,Lipiec 2007, s. 216–234 ( ISSN 0019-5499 , PMID 18341218 , czytaj online , dostęp 18 grudnia 2017 )
- A. McCall , BS Glaeser , W. Millington i RJ Wurtman , „ Neurotoksyczność glutaminianu sodu, hiperosmolarność i dysfunkcja bariery krew-mózg ”, Neurobehavioral Toxicology , tom. 1, N O 4,1979, s. 279–283 ( ISSN 0191-3581 , PMID 121936 , czytaj online , dostęp 18 grudnia 2017 )
- Amod Sharma , „ Uszkodzenie nerek wywołane glutaminianem sodu i możliwe mechanizmy: mini-przegląd ”, Journal of Biomedical Science , vol. 22,22 października 2015, s. 93 ( ISSN 1423-0127 , PMID 26493866 , PMCID PMC4618747 , DOI 10.1186 / s12929-015-0192-5 , czytaj online , dostęp 18 grudnia 2017 )
- Jean-Pierre Gies Yves Landry, Farmakologia. Cele w kierunku wskazania terapeutycznego , Dunod,2009, 2 II wyd.
- (w) Dingledine R Borges K, Bowie D Traynelis SF, „ Kanały jonowe receptora glutaminianu ” , Pharmacol Rev , Vol. 51, n o 1,Marzec 1999, s. 7–61. ( PMID 10049997 )
- (w) Andersson O Stenqvist A Attersand A, von Euler G., „ Sekwencja nukleotydów, organizacja genomu i lokalizacja chromosomalna genów kodujących ludzkie podjednostki receptora NMDA i NR3A NR3B ” , Genomics , tom. 78, n o 3,grudzień 2001, s. 178–84. ( PMID 11735224 , DOI 10.1006 / geno.2001.6666 )
- (en) Sakiko Okumoto i in. , „ Wykrywanie uwalniania glutaminianu z neuronów za pomocą kodowanych genetycznie nanoczujników FRET wyświetlanych na powierzchni ” , Proceedings of the National Academy of Sciences ,2005( PMID 15939876 , PMCID PMC1143584 , DOI 10.1073 / pnas.0503274102 , podsumowanie )
- (w) Rosana CT Mori , Regina B. Guimarães , MO Cláudia Nascimento i Eliane B. Ribeiro , " Boczna odpowiedź serotoninergiczna podwzgórza na przyjmowanie pokarmu w otyłości szczurów mierzona przez mikrodializę " , Can. J. Physiol. Pharmacol. , vol. 77, n o 4,1999, s. 286–292 ( DOI 10.1139 / cjpp-77-4-286 ).
- (w) Manev H Favaron M, Guidotti A, E Costa, „ Opóźniony wzrost napływu Ca2 + wywołany przez glutaminian: rola w śmierci neuronów ” , Mol. Pharmacol. , vol. 36, n o 1,Lipiec 1989, s. 106-12 ( PMID 2568579 , czytaj online )
- BS Meldrum *, MT Akbar, AG Chapman , „ Receptory i transportery glutaminianu w genetycznych i nabytych modelach epilepsji ”, Epilepsy Research , vol. 36,1999, s. 189-204
- S. Jinap, P. Hajeb , „ Glutaminian. Jej zastosowanie w pożywieniu a wpływ na zdrowie ”, Appetite , t. 55,2010, s. 1-10
- Kumiko Ninomiya , „ Natural Occurrence ”, Food Reviews International , t. 14, n kość 2-3,1998( czytaj online )
- (w) LJ Filer Garattini MR, MR Kare, WA Reynolds i RJ Wurtman, Kwas glutaminowy, postępy w biochemii i fizjologii , Raven Press,1979
- S. Jinap, P. Hajeb , „ Glutaminian. Jej zastosowanie w pożywieniu a wpływ na zdrowie ”, Appetite , t. 55,2010, s. 1-10
- definiowana jako hedoniczna ocena właściwości ustno-sensorycznych żywności w standardowych warunkach (Sorensen et al.2003 )
- (en) France Bellisle , „ Effects of monosodium glutaminate on human food food ” , Ann NY Acad Sci , vol. 855,1998, s. 438-41.
- (w) Yamaguchi S, Ninomiya K „ Umami i smakowitość żywności ” , J Nutri , vol. 130 (dodatek 4S),2000
- (en) Francja Bellisle , „ Badania eksperymentalne wyborów żywieniowych i odpowiedzi na smakowitość u europejskich badanych narażonych na smak Umami ” , Asia Pac J Clin Nutr , tom. 17 (dodatek 1),2008
- Boston University, Harvard University, Northwestern University i UCLA
- (w) Raif S. Geha, Alexa Beiser, Clement Ren Roy Patterson, Paul A. Greenberger, Leslie C. Grammer, Anne M. Ditto, Kathleen E. Harris, Martha A. Shaughnessy, Paul R. Yarnold Jonathan Corren and Andrew Saxon, „ Wieloośrodkowe, podwójnie ślepe, kontrolowane placebo, wieloetapowa ocena zgłoszonych reakcji na glutaminian sodu ” , Journal of Allergy Clinical Immunology , tom. 106 n O 5,2000, s. 973-980.
- 130 zrekrutowanych badanych, którzy powiedzieli, że doświadczyli syndromu chińskiej restauracji, zostało poddanych serii testów z napojem zawierającym 5 g glutaminianu sodu w porównaniu z placebo. Jeśli odpowiedzieli pozytywnie na pierwszy test, z co najmniej dwoma objawami, badano je zgodnie z drugim protokołem, szukając efektu zależności od dawki i odtworzenia reakcji. Jednak tylko połowa z tych, którzy mieli reakcję na 5 g GMS, a nie na placebo, zareagowała w sposób podobny do poniższego protokołu, co sugeruje niespójność w odpowiedziach. W poniższych protokołach osoby, które pozytywnie zareagowały na 5 g glutaminianu sodu, a nie na placebo, musiały połykać kapsułki (tak, aby nie miały wskaźnika smaku) na czczo lub podczas śniadania. Tylko dwóch badanych wykazywało spójne odpowiedzi na glutaminian. Wreszcie, wyniki sugerują, że duże dawki glutaminianu sodu przyjmowane bez jedzenia mogą wywoływać więcej objawów niż placebo u osób, które uważają, że są wrażliwe na glutaminian. Jednak podczas kolejnych testów nie zaobserwowano trwałego efektu.
- http://www.umamiinfo.com/richfood/
- http://www.takabio.com/fr/qui-sommes-nous-/les-enzymes-et-le-5eme-gout-l-umami.html