Acetylen
| Acetylen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trójwymiarowa struktura acetylenu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nazwa IUPAC | ethyne | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O ECHA | 100 000 743 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O WE | 200-816-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 6326 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| UŚMIECHY |
C # C , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1S / C2H2 / c1-2 / h1-2H |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | bezbarwny gaz rozpuszczony w acetonie pod ciśnieniem | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości chemiczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formula |
C 2 H 2 [Izomery] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa cząsteczkowa | 26,0373 ± 0,0017 g / mol C 92,26%, H 7,74%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości fizyczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fuzja | −80,7 ° C ( punkt potrójny ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * Temperatura wrzenia | -84,7 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rozpuszczalność | 1,185 g l −1 (woda, 20 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa objętościowa |
równanie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura samozapłonu | 305 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura zapłonu | Palny gaz | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Granice wybuchowości w powietrzu | 2,3 - 100 % obj | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nasycenie prężności par | przy 20 ° C : 4460 kPa
równanie:
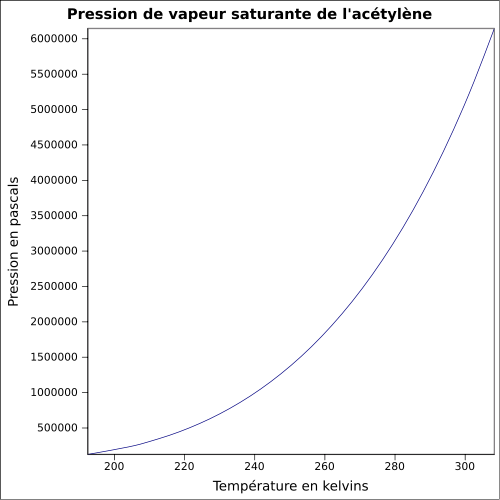
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punkt krytyczny |
35,2 ° C 61,38 bar 0,1122 l / mol |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Potrójny punkt | -80,8 ° C przy 1,2825 bara | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochemia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gaz S 0 , 1 bar | 200,93 J mol −1 K −1 ( 1 bar ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gaz Δ f H 0 | 226,73 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
44,04 J mol −1 K −1 w 25 ° C
równanie:
równanie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SZT | 1 301,1 kJ · mol -1 ( 25 ° C , gaz) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości elektroniczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 energia re jonizacji | 11,400 ± 0,002 eV (gaz) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalografia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klasa kryształu lub grupa kosmiczna | Pa 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametry siatki |
a = 6,140 Å b = 6,140 Å |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tom | 231,48 A 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Środki ostrożności | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Niebezpieczeństwo H220, EUH006, H220 : Skrajnie łatwopalny gaz EUH006 : Niebezpieczeństwo wybuchu w kontakcie lub bez kontaktu z powietrzem |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, B1, F, A : Temperatura krytyczna gazu sprężonego = 36,3 ° C B1 : Gaz palny dolna granica palności = 2,5% F : Materiał niebezpiecznie reaktywny podlegający gwałtownej reakcji rozkładu Ujawnienie przy 1,0% zgodnie z kryteriami klasyfikacyjnymi Uwagi: Proszę również zapoznać się z klasyfikacją WHMIS rozpuszczonego acetylenu . |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 0 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
239 : gaz palny, który może spontanicznie wywołać gwałtowną reakcję Numer UN : 1001 : ACETYLEN ROZPUSZCZONY Klasa: 2.1 Kod klasyfikacyjny: 4F : Gaz rozpuszczony pod ciśnieniem, łatwopalny; Etykieta: 2.1 : Gazy łatwopalne (odpowiada grupom oznaczonym dużą literą F); 
- Numer UN : 3374 : ACETYLEN BEZ ROZPUSZCZALNIKA Klasa: 2.1 Kod klasyfikacyjny: 2F : Gaz skroplony, łatwopalny; Etykieta: 2.1 : Gazy łatwopalne (odpowiada grupom oznaczonym dużą literą F);  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekotoksykologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 0.37 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Próg zapachu | niska: 226 ppm wysoka: 2584 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jednostki SI i STP, chyba że określono inaczej. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Acetylen (zwany acetylen w nomenklaturze IUPAC ) jest związkiem chemicznym węglowodór klasa alkinów o wzór empiryczny C 2 H 2. Został odkryty przez Edmunda Davy'ego w Anglii w 1836 roku . Jest to najprostszy alkin, składający się z dwóch atomów węgla i dwóch wodoru . Dwa atomy węgla są połączone potrójnym wiązaniem, które zawiera większość jego energii chemicznej.
Opis
Berthelot , w 1862 roku , był najpierw syntezować acetylenu w urządzeniu zwanym „Berthelot jajo”, przez wytworzenie łuku elektrycznego pomiędzy dwiema elektrodami z grafitu zanurzona w atmosferze wodoru : 2 C + H 2 → C 2 H 2
Acetylen jest bezbarwnym gazem , praktycznie bezwonnym, gdy jest czysty (ale zazwyczaj przypisuje się mu charakterystyczny zapach czosnku, który pochodzi z zanieczyszczeń, zwłaszcza fosfiny, gdy jest produkowany z węglika wapnia ).
Acetylen jest wyjątkowo łatwopalny w normalnej temperaturze i ciśnieniu . Jest endoenergetyczny w odniesieniu do węgla i wodoru i może rozkładać się samorzutnie, wybuchowo, gdy ciśnienie jest większe niż 100 kPa , i do kilku barów, gdy ten spontaniczny rozkład zachodzi nieuchronnie . Z tego powodu jest przechowywany w postaci rozpuszczonej w acetonie lub dimetyloformamidzie (DMF), zawartych w porowatym materiale stabilizującym.
posługiwać się
Zastosowania acetylenu:
- Wysoka zawartość węgla daje bardzo rozświetlający płomień stosowany na przykład w lampach acetylenowych (kalabry) dla górników lub speleologów.
- Wysokie ciepło spalania acetylenu osiąga wysokie temperatury ( 3200 ° C w czystym tlenie), co czyni go idealnym kandydatem jako paliwo do spawania. Jedną z osobliwości spalania acetylenu jest jego dwustopniowe spalanie: acetylen najpierw reaguje z tlenem, dając tlenek węgla i wodór , a następnie produkty te reagują w drugim etapie, tworząc dwutlenek węgla i wodę. Tlenek węgla i wodór są gazami redukującymi, co czyni je popularnymi odczynnikami w spawaniu stali do redukcji tlenków żelaza powstałych w wyniku reakcji żelaza z tlenem w wysokiej temperaturze, umożliwiając tym samym lepszą homogenizację spoiny, a tym samym lepszą jakość tego ostatniego. Spawanie acetylenem pozwala na łączenie różnych metali ( stali , stali nierdzewnej, stopów miedzi ), ale także w określonych warunkach aluminium z dodatkiem krzemu .
- Acetylen jest również używany jako paliwo w urządzeniach analitycznych. Rzeczywiście, w atomowej spektrometrii absorpcyjnej (AAS), związanej z różnymi utleniaczami (powietrze, czysty tlen, podtlenek azotu), pozwala na jonizację pierwiastków typowo ziem alkalicznych i określenie ich stężenia dzięki prawu Beera-Lamberta .
- Acetylen jest również używany w palnikach do cięcia tlenowego. Jednak propan jest preferowany, ponieważ jest tańszy. Ale w przypadku bardzo grubych cięć acetylen jest niezbędny, aby wystarczająco podgrzać stal i zainicjować cięcie płomieniowe na małej szerokości.
- Reakcja acetylenu z kwasem solnym jest jednym ze sposobów wytwarzania chlorku winylu (monomer polichlorku winylu ).

Właściwości fizykochemiczne
Właściwości chemiczne acetylenu w dużej mierze tłumaczy się obecnością w jego cząsteczce wiązania potrójnego wynikającego z nałożenia się pojedynczego wiązania s (będącego wynikiem fuzji dwóch orbitali sp ) i dwóch wiązań p powstałych w wyniku połączenia dwóch orbitali 2p . To wiązanie o długości 0,124 nm i charakteryzujące się energią 811 kJ jest mniej stabilne niż wiązania pojedyncze (614 kJ ) i podwójne (347,3 kJ ), a przez to bardziej reaktywne.
Reakcje acetylenu
- Acetylen i monoalkiloacetyleny to jedyne węglowodory, które mają wodór o charakterze kwasowym i które można wymienić na metal.
- Niektóre, takie jak acetylenidy, wybuchają przy uderzeniu.
- Acetylen reaguje z kwasem cyjanowodorowym, tworząc akrylonitryl , monomer akrylonitrylo-butadieno-styrenu (ABS) i styren-akrylonitryl (SAN).
- Acetylen daje benzen przez polimeryzację pod działaniem ciepła.
- W wyniku dimeryzacji w obecności katalizatorów uzyskuje się winyloacetylen, do którego dodaje się chlorowodór w celu uzyskania monomeru chloroprenu, polichloroprenu lub neoprenu .
Produkcja i synteza
Acetylen nie występuje naturalnie (w węglowodorach czasami występują inne alkiny). Główne przemysłowe metody produkcji acetylenu to:
Metoda karbochemiczna
Jako surowce używane są wapień i koks lub węgiel drzewny. W piecu wysokotemperaturowym ( minimum 1700 ° C ) ogrzewanym przez prąd elektryczny przepływający przez stopione medium reakcyjne , węglik wapnia jest wytwarzany zgodnie z reakcjami: CaCO 3 → CaO + CO 2, CaO + 3 C + 108,300 kalorii → CaC 2 + CO.
U użytkownika węglik reaguje z wodą tworząc acetylen, 1 kg węglika łączy się z 562,5 g wody w celu uwolnienia 350 l acetylenu: CaC 2 + 2 H 2 O → C 2 H 2 + Ca (OH) 2 + 31 000 kalorii.
Częściowe spalanie metanu
Częściowe spalanie metanu wytwarza również acetylen: 3 CH 4 + 3 O 2 → C 2 H 2 + CO + 5 H 2 O.
Odwodnienie alkanów
Najcięższe alkany w ropie naftowej i gazie ziemnym są krakowane na lżejsze cząsteczki, które są odwodorniane w wysokich temperaturach: C 2 H 6 → C 2 H 2 + 2 H 2.
Uwagi i odniesienia
- ACETYLEN , arkusz (e) bezpieczeństwa międzynarodowego programu w sprawie bezpieczeństwa substancji chemicznych , konsultowany w dniu 9 maja 2009
- obliczona masa cząsteczkowa od „ atomowych jednostek masy elementów 2007 ” na www.chem.qmul.ac.uk .
- (en) David R. Lide , CRC Handbook of Chemistry and Physics, 89. wydanie , Boca Raton, CRC Press / Taylor and Francis,2009, „Stałe fizyczne związków organicznych”
- Wpis „Acetylen” w chemicznej bazie danych GESTIS IFA (niemieckiego organu odpowiedzialnego za bezpieczeństwo i higienę pracy) ( niemiecki , angielski ), dostęp 14 kwietnia 2009 (wymagany JavaScript)
- (en) Robert H. Perry i Donald W. Green , Perry's Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , str. 2-50
- Clark, AM; Din, F., Równowagi między fazami stałymi, ciekłymi i gazowymi w układach dwuskładnikowych w niskiej temperaturze acetylen - dwutlenek węgla, acetylen - etylen i acetylen - etan, Trans. Faraday Soc., 1950, 46, 901.
- Tsonopoulos, C.; Ambrose, D., Vapor-Liquid Critical Properties of Elements and Compounds. 6. Nienasycone węglowodory alifatyczne, J. Chem. Inż. Data, 1996, 41, 645-656.
- „ Acetylene ” , pod adresem http://www.nist.gov (dostęp: 14 kwietnia 2009 r. )
- (w) Carl L. Yaws, Podręcznik diagramów termodynamicznych , t. 1, 2 i 3, Huston, Texas, Gulf Pub. Współ.,1996( ISBN 0-88415-857-8 , 978-0-88415-858-5 i 978-0-88415-859-2 )
- (w) David R. Lide , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,18 czerwca 2002, 83 th ed. , 2664 s. ( ISBN 0849304830 , prezentacja online ) , str. 5-89
- (w) David R. Lide, Podręcznik chemii i fizyki , CRC,2008, 89 th ed. , 2736 str. ( ISBN 978-1-4200-6679-1 ) , str. 10-205
- " Acetylene " , na www.reciprocalnet.org (dostęp 12 grudnia 2009 )
- Numer indeksu w tabeli 3.1 załącznika VI rozporządzenia WE nr 1272/2008 (16 grudnia 2008)
- „ acetylen ” w bazie produktów chemicznych Reptox z CSST (Quebec organizacji odpowiedzialnej za bezpieczeństwo i higienę pracy), dostęp 24 kwietnia 2009
- „ Acetylene, ” na hazmap.nlm.nih.gov (dostęp 14 listopada 2009 )
- Nowak Ph. (1999) - "L ' acétylène ", " Le P'tit Usania n o 7 " , w USAN (dostęp 5 stycznia 2021 ) ( ISSN 1292-5950 ) , USAN, Nancy, s. 1
Zobacz też
Powiązane artykuły
- Hydrataza acetylenowa
- Alcyne
- Lampa acetylenowa
- Louis Bleriot
- Frédéric Chaplet
- Henri moissan
- Walter Reppe











