N- bromosukcynimid
| N- bromosukcynimid | |
| Struktura NBS | |
| Identyfikacja | |
|---|---|
| Nazwa IUPAC | 1-bromopirolidyno-2,5-dion |
| Synonimy |
NBS |
| N O CAS | |
| N O ECHA | 100,004,435 |
| N O WE | 204-877-2 |
| UŚMIECHY |
O = C1CCC (= O) N1Br , |
| InChI |
InChI: InChI = 1 / C4H4BrNO2 / c5-6-3 (7) 1-2-4 (6) 8 / h1-2H2 |
| Wygląd | jednolity biały |
| Właściwości chemiczne | |
| Brute formula |
C 4 H 4 Br N O 2 [Izomery] |
| Masa cząsteczkowa | 177,984 ± 0,005 g / mol C 26,99%, H 2,27%, Br 44,89%, N 7,87%, O 17,98%, |
| Środki ostrożności | |
| SGH | |
  Niebezpieczeństwo H302, H314, P280, P310, P305 + P351 + P338, H302 : Działa szkodliwie po połknięciu H314 : Powoduje poważne oparzenia skóry i uszkodzenia oczu P280 : Nosić rękawice ochronne / odzież ochronną / ochronę oczu / ochronę twarzy. P310 : Natychmiast skontaktować się z OŚRODKIEM ZATRUĆ lub lekarzem. P305 + P351 + P338 : W przypadku dostania się do oczu: Ostrożnie płukać wodą przez kilka minut. Zdejmij soczewki kontaktowe, jeśli ofiara je nosi i można je łatwo zdjąć. Kontynuuj płukanie. |
|
| Jednostki SI i STP, chyba że określono inaczej. | |
N -bromosukcynoimid lub NBS jest związek bromowanych wykorzystywane do radykalnej zmiany i elektrofilowe dodatki w chemii organicznej . Jest zdolny do bromowania dużej liczby związków.
Użyj w syntezie
Dodatek alkenów
NBS może reagować z alkenem 1 w środowisku wodnym, dając bromohydrynę 2 . Optymalne warunki odpowiadają dodaniu NBS do alkenu roztworu w mieszaninie 50/50 wodą i DMSO , DMF , THF i tert -butanolu w 0 ° C . Tworzenie jonu bromoniowego i natychmiastowy atak wody wymaga ścisłej addycji Markownikowa i anty- stereochemii .
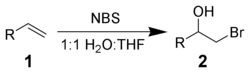
Obserwuje się reakcje uboczne, takie jak tworzenie α-bromo-ketonów lub związków dibromo. Można je zminimalizować, stosując świeżo rekrystalizowany NBS .
Dodatek nukleofila zamiast wody umożliwia syntezę różnych dwufunkcjonalizowanych alkanów.

Bromowanie alliliczne i benzylowe
Jest to rodnik bromowania znany również jako reakcja Wohla-Zieglera . Konwencjonalne warunki stosowania NBS w postaci roztworu w bezwodnej CCI 4 , z inicjatorem rodnikowym (tradycyjnie AIBN lub nadtlenek benzoilu ) lub napromieniowanie. Rodniki allilowe i benzylowe powstałe podczas reakcji są trwalsze niż inne rodniki węglowe, a dominującymi produktami są bromki allilu i benzylu.

Medium musi pozostać całkowicie bezwodne przez całą reakcję, a pożądany produkt łatwo ulega hydrolizie . Węglan baru jest często stosowany do utrzymania tych bezwodnych warunkach, nie kwasowe.
Bromowanie pochodnych karbonylu
Bromowaniu NBS można przeprowadzić w alfa związków karbonylowych za pomocą mechanizmu rodnikowego (analogicznie do reakcji Wohl-Zieglera) lub za pomocą katalitycznego kwasu. Zatem chlorek heksanoilu 1 można poddać bromowaniu do α za pomocą NBS z zastosowaniem katalizy kwasowej.
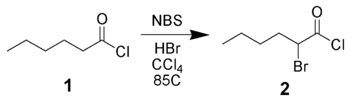
Zastosowanie NBS jest metodą stosowaną głównie do α-bromowania enolanów , eterów enolu lub octanów enolu ze względu na jego wysoką wydajność i niewielką ilość produktów ubocznych.
Bromowanie pochodnych aromatycznych
Związki aromatyczne wzbogacone w elektrony, takie jak fenole , aniliny i szereg heterocykli , mogą być bromowane przez NBS. Użycie DMF jako rozpuszczalnika umożliwia uzyskanie silnej para- selektywności.
Uwagi i odniesienia
- obliczona masa cząsteczkowa od „ atomowych jednostek masy elementów 2007 ” na www.chem.qmul.ac.uk .
- Karta danych bezpieczeństwa opracowana przez Sigma-Aldrich https://www.sigmaaldrich.com/MSDS/MSDS/DisplayMSDSPage.do?country=FR&language=fr&productNumber=B81255&brand=ALDRICH&PageToGoToURL=https%3A%2FigmaFalogctald% 2Frichbald% 2Frichbald% 2Frichbald % 3Dfr konsultowane w dniu 05/12/219
- Hanzlik, RP, Selektywna epoksydacja końcowych wiązań podwójnych , Org. Synth. , pot. „lot. 6 ”, str. 560
- (w) Beger, J., „ Präparative Aspekte elektrophiler Dreikomponentenreaktionen put Alkenen ” , Journal fur praktische Chemie , vol. 333 n O 5,1991, s. 677–698 ( DOI 10.1002 / prac.19913330502 )
- Haufe, G.; Alvernhe, G.; Laurent, A.; Ernet, T.; Goj, O .; Kröger, S.; Sattler, A., Bromofluorination of alkenes , Org. Synth. , pot. „lot. 10 ",2004, s. 128
- (w) A. Wohl, „ Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge ” , Chemische Berichte , vol. 52,1919, s. 51 ( DOI 10.1002 / cber.19190520109 )
- (en) Karl Ziegler, et al. , „ Die Synthese des Cantharidins ” , Justus Liebigs Annalen der Chemie , vol. 551,1942, s. 30 ( DOI 10.1002 / jlac.19425510102 )
- (w) Carl Djerassi , „ Brominacje z N-bromosukcynimidem i związkami pokrewnymi. The Wohl-Ziegler Reaction ” , Chemical Reviews , tom. 43,1948, s. 271 ( DOI 10.1021 / cr60135a004 )
- FL Greenwood; MD Kellert; J. Sedlak, 4-bromo-2-hepten , Org. Synth. , pot. „lot. 4 ",1963, s. 108
- (en) Binkley, R. W, Goewey, G. S i Johnston, J, „ regioselective ring Opening of benzylidene acetals selected. A zainicjowana fotochemicznie reakcja częściowego odbezpieczenia węglowodanów ” , Journal of Organie Chemistry , tom. 49,1984, s. 992 ( DOI 10.1021 / jo00180a008 )
- Harpp, DN; Bao, LQ; Coyle, C.; Gleason, JG; Horovitch, S., chlorek 2-bromoheksanoilu , Org. Synth. , pot. „lot. 6 ",1988, s. 190
- (w) PL Stotter i KA Hill , „ związki α-halokarbonylowe. II. Przygotowanie α-bromoketonów w zależności od pozycji przez bromowanie enolanów litu. Specyficzne dla pozycji wprowadzenie α, β-nienasycenia do niesymetrycznych ketonów ” , J. Org. Chem. , vol. 38,1973, s. 2576 ( DOI 10.1021 / jo00954a045 )
- (en) JM Stewart , DJ O'Dea GC Shapiro , MB Patel JT Mcintyre MH Gewitz CT Hoegler JT Shapiro i GA Zeballos , " Various glikozylowe dawców z ketonu lub grupa funkcyjna oksymu centrum obok anomeryczne: łatwy Przygotowanie i ocena ich selektywności w glikozydacjach ” , Synthesis , vol. 1992 N O 9,1992, s. 179 ( PMID 1839242 , DOI 10.1055 / s-1992-34167 )
- Amat, M .; Hadida, S.; Sathyanarayana, S.; Bosch, J., Regioselective synthesis of 3-basic indoles , Org. Synth. , pot. „lot. 9 ",1998, s. 417
- (in) HW Gilow i DE Burton , „ Bromowanie i chlorowanie pirolu i niektórych reaktywnych 1-podstawionych piroli ” , Journal of Organie Chemistry , tom. 46,Dziewiętnaście osiemdziesiąt jeden, s. 2221 ( DOI 10.1021 / jo00324a005 )
- Brown. WD; Gouliaev, AH, Synthesis of 5-bromoisoquinoline and 5-bromo-8-nitroisoquinoline , Org. Synth. 81 , pot. „lot. ",2005, 98 pkt.
- (in) RH Mitchell , YH Lai i RV Williams , „ N-dimetyloformamid-bromosukcynimid: łagodny, selektywny odczynnik dla reaktywnych związków aromatycznych monobromowania jądrowego ” , Journal of Organie Chemistry , vol. 44,1979, s. 4733 ( DOI 10.1021 / jo00393a066 )
- ( fr ) Ten artykuł jest częściowo lub w całości zaczerpnięty z artykułu w angielskiej Wikipedii zatytułowanego „ N-Bromosuccinimide ” ( zobacz listę autorów ) .