Bromowodór
| Bromowodór | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nazwa IUPAC | Bromowodór | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O ECHA | 100,030,090 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O WE | 233-113-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | Gaz sprężony, skroplony, bezbarwny, o ostrym zapachu. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości chemiczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formula |
H Br [Izomery] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa cząsteczkowa | 80,912 ± 0,001 g / mol H 1,25%, Br 98,75%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | -9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moment dwubiegunowy | 0,8272 ± 0,0003 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości fizyczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fuzja | -87 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * Temperatura wrzenia | -67 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rozpuszczalność | w wodzie o temperaturze 20 ° C : 1 930 g · l -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
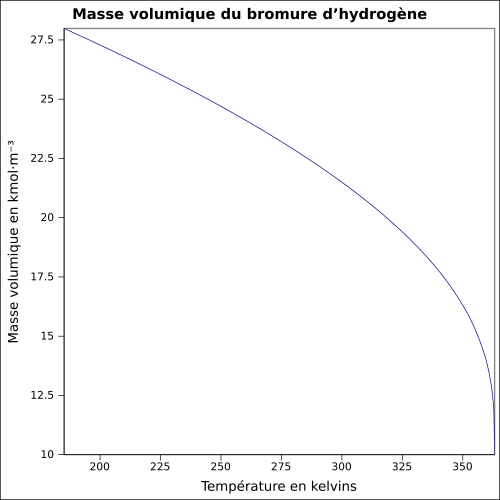
| Masa objętościowa |
1,8 g · cm -3
równanie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nasycenie prężności par | przy 20 ° C : 2445 kPa
równanie:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punkt krytyczny | 85,5 bara , 90,05 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szybkość dźwięku | 200 m · s -1 ( 0 ° C , 1 atm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochemia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gaz S 0 , 1 bar | 198,7 J / mol K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gaz Δ f H 0 | –36,3 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° | 12,69 kJ · mol -1 ( 1 atm , 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
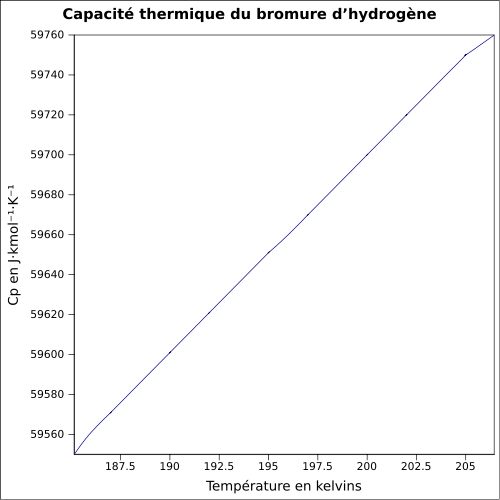
| C p | 29,1 J / mol K ( 25 ° C )
równanie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Środki ostrożności | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Niebezpieczeństwo H314, H335, H314 : Powoduje poważne oparzenia skóry i uszkodzenia oczu H335 : Może podrażniać drogi oddechowe |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, D1A, E, A : Absolutne ciśnienie sprężonego gazu przy 54,4 ° C = 4130 kPa D1A : Bardzo toksyczny materiał wywołujący poważne natychmiastowe skutki Transport towarów niebezpiecznych: klasa 2.3 E : Materiał żrący Transport towarów niebezpiecznych: klasa 8 Ujawnienie 1,0% zgodnie z wykazem ujawnień składników |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 0 3 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1048 : BEZWODNY BROMEK WODORU |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inhalacja | toksyczny | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skóra | Bardzo żrący | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oczy | Bardzo żrący | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekotoksykologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Próg zapachu | niska: 2 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jednostki SI i STP, chyba że określono inaczej. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Bromowodór , symbol chemiczny HBr jest gaz bezbarwny toksyczny i bardzo żrący , który tworzy białe dymy w kontakcie z wilgocią . Opary te składają się z kwasu bromowodorowego , który powstaje po rozpuszczeniu bromowodoru w wodzie . Bromowodór to substancja chemiczna szeroko stosowana w chemii , przemyśle czy laboratoriach. Nazwa HBr czasami niewłaściwie odnosi się do kwasu bromowodorowego zamiast gazowego bromowodoru. Chemicy mówią również o gazowym lub bezwodnym kwasie bromowodorowym w odniesieniu do bromowodoru.
Historia
Bromowodór został zbadany i przygotowany przez chemika Antoine-Jérôme Balarda podczas jego odkrycia bromu na słonych bagnach w pobliżu Montpellier.
Chemia
Cząsteczka bromowodoru HBr jest cząsteczką dwuatomową składającą się z atomu wodoru H i atomu bromu Br, połączonych pojedynczym wiązaniem kowalencyjnym . Ponieważ brom jest bardziej elektroujemny niż wodór, wiązanie jest spolaryzowane . W rezultacie cząsteczka przenosi moment dipolowy , z ujemnym ładunkiem cząstkowym δ- niesionym przez atom bromu i dodatnim ładunkiem cząstkowym δ + przenoszonym przez atom wodoru. Dlatego bromowodór jest cząsteczką polarną i jest bardzo dobrze rozpuszczalny w wodzie i rozpuszczalnikach polarnych. Roztwory kwasu bromowodorowego są nasycone wagowo 68,85% HBr. W temperaturze pokojowej bromowodór jest gazem o ostrym zapachu, palącym się w wilgotnym powietrzu z powodu tworzenia się kwasu bromowodorowego.
Produkcja przemysłowa
Bromowodór jest produkowany przemysłowo w małych ilościach w porównaniu z chlorowodorem i kwasem solnym, które są głównymi produktami przemysłu chemicznego . Najczęstszym sposobem przygotowania HBr jest mieszanie diwodoru i bromu w wysokiej temperaturze ( 200 do 400 ° C ). Reakcja jest generalnie katalizowana przez platynę .
Synteza bromowodoru
Przygotowanie HBr odbywa się wieloma metodami.
Bardzo prosty syntezy wykorzystuje reakcję pomiędzy kwasem siarkowym i bromku sodu :
NaBr (s) + H 2 SO 4 (aq) → NaHSO 4 (s) + HBr (g)Jednak ta synteza nie ma dobrej wydajności, ponieważ utworzony bromowodór jest utleniany do dibromy przez kwas siarkowy:
2HBr (g) + H 2 SO 4 (aq) → Br 2 (g) + SO 2 (g) + 2H 2 O (l)W tej metodzie można stosować kwasy nieutleniające, takie jak kwas octowy lub kwas fosforowy .
Redukcję dibroma od kwasu fosforowego albo przez dwutlenkiem siarki umożliwia również uzyskanie HBr:
Br 2 + H 3 PO 3 + HO - → H 2 PO 4 - (s) + 2HBr (g) Br 2 + SO 2 + 2H 2 O → H 2 SO 4 + 2HBr (g)Wreszcie hydroliza bromków metali umożliwia utworzenie bromowodoru, który jest po prostu mokry i zanieczyszczony śladami ciał biorących udział w reakcji z dobrą wydajnością. Jest to powszechnie stosowany proces.
Bromowodór zawsze powoduje opary wody bromowej. Są one usuwane przez pastę z czerwonego fosforu i wody lub kwasu bromowodorowego, która jest przepuszczana przez małe fragmenty szklanych probówek. Suchy i bez bromu gaz nie atakuje już gumy.
Używa
Bromowodór ma wiele zastosowań w syntezie produktów organicznych.
Na przykład służy do produkcji bromków alkilu z alkoholi:
ROH + HBr → R + OH 2 + Br - → RBr + H 2 ODodaje się go do alkenów, aby uzyskać bromoalkany:
RCH = CH 2 + HBr → RCH (Br) –CH 3Jest dodawany do alkinów w celu utworzenia bromoalkenów. Stereochemię tego typu dodatku jest anty:
RC≡CH + HBr → RCH (Br) = CH 2Dodawany jest do haloalkenów w celu utworzenia geminalnego dihaloalkanu . Ten rodzaj dodawania jest zgodny z regułą Markownikowa :
RC (Br) = CH 2 + HBr → RC (Br 2 ) –CH 3Bromowodór jest również używany do otwierania epoksydów i laktonów, a także w syntezie bromoacetali. I wreszcie bromowodór jest katalizatorem wielu reakcji organicznych.
bezpieczeństwo
Bromowodór reaguje z większością metali w obecności wilgoci, tworząc wodór , bardzo łatwopalny gaz. Reakcja z zasadami może być bardzo gwałtowna. Reaguje również z wodą tworząc kwas bromowodorowy , a mocny kwas . Ten produkt nie może przedostać się do środowiska, ponieważ powoduje zmianę pH wody. Zmieszany z wodą powoduje szybką korozję . Bromowodór jest gazem cięższym od powietrza i może gromadzić się pod ziemią lub w ograniczonych przestrzeniach. W wilgotnej atmosferze uwalniane są białe opary.
Linki zewnętrzne
Kompletna karta charakterystyki
Zobacz też
Bibliografia
- BROMOWODÓR , karta (e) bezpieczeństwa Międzynarodowego Programu Bezpieczeństwa Chemicznego , konsultacja 9 maja 2009
- (w) David R. Lide, Podręcznik chemii i fizyki , Boca Raton, CRC,16 czerwca 2008, 89 th ed. , 2736 str. ( ISBN 978-1-4200-6679-1 i 1-4200-6679-X ) , str. 9-50
- obliczona masa cząsteczkowa od „ atomowych jednostek masy elementów 2007 ” na www.chem.qmul.ac.uk .
- (en) Robert H. Perry i Donald W. Green , Perry's Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , str. 2-50
- „ Properties of Various Gases ” na stronie flexwareinc.com (dostęp 12 kwietnia 2010 )
- (w) W. M Haynes, Handbook of Chemistry and Physics , CRC, 2010-2011 91 th ed. , 2610 s. ( ISBN 978-1-4398-2077-3 ) , str. 14-40
- (w) David R. Lide, CRC Handbook of Chemistry and Physics , CRC Press,2009, 90 th ed. , 2804 s. , Twarda oprawa ( ISBN 978-1-4200-9084-0 )
- Numer indeksu w tabeli 3.1 załącznika VI do rozporządzenia WE nr 1272/2008 (16 grudnia 2008)
- „ Bromowodór ” w bazie produktów chemicznych Reptox z CSST (Quebec organizacji odpowiedzialnej za bezpieczeństwo i higienę pracy), dostęp 23 kwietnia 2009
- „ Hydrogen bromide ” at hazmap.nlm.nih.gov (dostęp 14 listopada 2009 )