Cykloheksan
| cykloheksan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
    Różne reprezentacje cząsteczki cykloheksanu. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nazwa IUPAC | cykloheksan | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O ECHA | 100,003,461 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O WE | 203-806-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank | DB03561 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 8078 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 29005 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| UŚMIECHY |
C1CCCCC1 , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / C6H12 / c1-2-4-6-5-3-1 / h1-6H2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | bezbarwna ciecz | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości chemiczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formula |
C 6 H 12 [Izomery] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa cząsteczkowa | 84,1595 ± 0,0056 g / mol C 85,63%, H 14,37%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Podatność magnetyczna | 68,1 × 10-6 cm 3 · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości fizyczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fuzja | 6,47 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * Temperatura wrzenia | 80,75 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rozpuszczalność | w wodzie: brak; ziemia. w alkoholu , eterze , acetonie ; |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametr rozpuszczalności δ | 16,8 MPa 1/2 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa objętościowa |
0,7786 g · cm -3 ( 25 ° C )
równanie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura samozapłonu | 260 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura zapłonu | −18 ° C (zamknięty tygiel) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Granice wybuchowości w powietrzu | 1,3 - 8,4 % obj | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nasycenie prężności par | przy 20 ° C : 12,7 kPa
równanie:
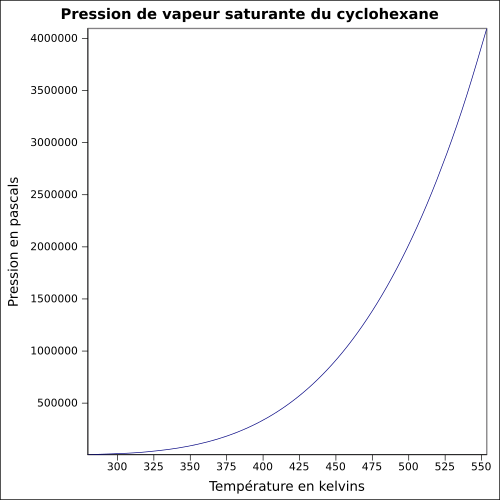
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lepkość dynamiczna | 0,98 mPa · s przy 20 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punkt krytyczny | 280,3 ° C , 40,7 bara | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szybkość dźwięku | 1280 m · s od -1 do 19 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochemia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° | 3,6 x 10 5 J · kg-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
równanie:
równanie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SZT | 3 919,6 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości optyczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Współczynnik załamania światła | 1.42662 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Środki ostrożności | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
    Niebezpieczeństwo H225, H304, H315, H336, H410, H225 : Wysoce łatwopalna ciecz i pary H304 : Połknięcie i dostanie się przez drogi oddechowe może grozić śmiercią H315 : Działa drażniąco na skórę H336 : Może wywoływać uczucie senności lub zawroty głowy H410 : Działa bardzo toksycznie na organizmy wodne, szkodliwie wpływając na organizm. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B2, D2B, B2 : łatwopalna ciecz Flash Temperatura = -18 ° C, zamknięty tygiel Setaflash sposób D2B : materiał toksyczny powoduje inne efekty toksyczne podrażnienia skóry u zwierząt, 1,0% ujawnienie według ujawnienia listy składników |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 1 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
33 : wysoce łatwopalny materiał ciekły (temperatura zapłonu poniżej 21 ° C ) Numer UN : 1145 : CYKLOHEKSAN Klasa: 3 Etykieta: 3 : Ciecze łatwopalne Opakowanie: Grupa pakowania II : substancje umiarkowanie niebezpieczne;  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekotoksykologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 | 930 - 1360 mg · kg -1 (szczury, doustnie) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 3.44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Próg zapachu | niska: 0,52 ppm wysoka: 784 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jednostki SI i STP, chyba że określono inaczej. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Cykloheksan jest węglowodór alicykliczne niż etylen z rodziny (mono) cykloalkanów o wzorze surowy C 6 H 12 . Cykloheksan jest stosowany jako rozpuszczalnik apolarny w przemyśle chemicznym, ale także jako odczynnik do przemysłowej produkcji kwasu adypinowego i kaprolaktamu , półproduktów do produkcji nylonu . Szkieletowych wzór cykloheksanu pokazano odwrotnie.
Produkcja
Podsumowania historyczne
W przeciwieństwie do innych węglowodorów cykloheksan nie występuje w przyrodzie. Dlatego kilku chemików starało się go zsyntetyzować:
- W 1867 Marcelin Berthelot przeszła do redukcji z benzenu przez kwasu jodowodorowego w wysokiej temperaturze. Nazywa swój produkt heksahydrobenzenem, myśląc, że go zsyntetyzował. W 1870 roku Adolf von Baeyer powtórzył tę reakcję i uzyskał ten sam produkt.
- W 1890 roku Władimir Markownikow wierzył, że ten sam produkt może uzyskać destylując kaukaską ropę. Nazywa swój produkt końcowy heksanaftenem.
Jednak oba produkty mają o około 10 ° C wyższą temperaturę wrzenia niż zestawiony w tabeli heksahydrobenzen i heksanaften. Niespójność została rozwiązana w 1895 roku przez V. Markownikowa , N. Kischnera (en) i N. Zelinsky'ego, którzy wykazali, że otrzymane produkty mają strukturę typu metylocyklopropanu, otrzymaną w wyniku nieoczekiwanej reakcji przegrupowania .
Dopiero 1894 że Baeyera syntetyzowane po raz pierwszy przez cykloheksan Dieckmann kondensacji z kwasem pimelinowy , a następnie przez kilka etapów redukcji .

W tym samym roku E. Haworth i WH Perkin Jr. (en) zsyntetyzowali cykloheksan, przeprowadzając reakcję Wurtza z 1,6-dibromoheksanem .

Obecna synteza
Obecnie cykloheksan wytwarzane w skali przemysłowej przez uwodornienie z benzenu, katalizowanej niklem Raney'a . Produkcja cykloheksanu pokrywa około 10% rocznego światowego zapotrzebowania na benzen . Reakcja prowadzona w wysokiej temperaturze jest wówczas silnie egzotermiczna z ΔH (500 K) = -216,37 kJ / mol. Reakcja odwodornienia jest znacząca tylko od 300 ° C , odzwierciedlając ujemną entropię reakcji dla reakcji uwodornienia.

Używa
Jako węglowodór cykloheksan jest słabo reaktywną cząsteczką. Jednak zdecydowana większość cykloheksanu jest wykorzystywana do katalitycznego utleniania do cykloheksanolu i cykloheksanonu . Te dwa związki są wykorzystywane odpowiednio do produkcji kwasu adypinowego , używanego jako surowiec do produkcji nylonu-6,6 oraz do produkcji kaprolaktamu , prekursora nylonu-6 . Każdego roku produkuje się kilka tysięcy ton cykloheksanolu i cykloheksanonu .
Cykloheksan jest również stosowany jako apolarny rozpuszczalnik organiczny, chociaż obecnie preferowany jest n-heksan . Jest często używany jako rozpuszczalnik do rekrystalizacji, ponieważ wiele związków organicznych jest rozpuszczalnych na gorąco w cykloheksanie, ale nie na zimno.
Cykloheksan jest również używany do kalibracji instrumentów do różnicowej kalorymetrii skaningowej ze względu na zmianę fazy krystalicznej netto przy 186 K. Opary cykloheksanu są również stosowane w urządzeniach do obróbki cieplnej.
Geometria
Podejście historyczne
W 1890 roku Hermann Sachse (de) , 28-letni asystent z Berlina, opublikował instrukcje składania arkusza papieru w celu przedstawienia dwóch form cykloheksanu, które nazwał „symetryczną” i „antysymetryczną” (dziś nazywaną krzesłem i łódką). . Rozumie, że dla każdego kształtu są dwa różne położenia atomów wodoru (obecnie zwane osiowymi i równikowymi), że dwa "symetryczne" kształty mogą się wzajemnie przekształcać, a nawet to, jak pewne podstawniki mogą faworyzować jeden lub drugi kształt. Inny ( teoria Sachse-Mohra (de) ). Niestety, wszystkie swoje odkrycia wyraża w języku matematycznym i niewielu chemików go rozumie. Zmarł w 1893 roku bez możliwości rozwinięcia się jego pomysłów.
W 1918 roku Ernst Mohr (de) przejął pracę nad Sachse. Bada wszystkie cykloalkany, aby rozwinąć swoją teorię. Przewiduje w szczególności, że istnieją dwie stabilne formy tej samej energii dla dekaliny , co zostanie potwierdzone przez Waltera Hückela (de) w 1925 r. Mohr będzie również miał pomysł, że dyfrakcja rentgenowska umożliwiłaby potwierdzenie jego teorii, ale technika jest zbyt nowa, aby można ją było niezawodnie stosować.
Dopiero w 1943 roku Odd Hassel mógł wykazać istnienie tych dwóch konformacji i dwóch nie równoważnych pozycji atomów wodoru, badając opary cykloheksanu metodą dyfrakcji elektronów .
Główne konformacje cykloheksanu
Ponieważ wiele związków ma 6-członową strukturę pierścieniową, struktura i dynamika cykloheksanu są ważnymi prototypami. Kąty sześciokąta foremnego płaskiego wynoszą 120 °. Jednak kąt utworzony przez dwa kolejne wiązania w łańcuchu węglowym wynosi około 109 ° zgodnie z teorią VSEPR . Dlatego cząsteczka cykloheksanu nie jest płaska, aby zminimalizować stres cykliczny.
Dominująca konformacja cykloheksanu w temperaturze pokojowej nazywana jest konformacją krzesła. Ponad 99% cząsteczek cykloheksanu w roztworze przyjmuje tę konformację w temperaturze 25 ° C. Wszystkie atomy węgla są tam równoważne, a atomy wodoru mają dwie różne pozycje: mówi się, że atom wodoru, który należy do środkowej płaszczyzny cyklu, znajduje się w pozycji równikowej, podczas gdy atom wodoru nie należący do tej płaszczyzny jest mówi się, że znajduje się w pozycji osiowej. Dlatego każdy atom węgla jest połączony z atomem wodoru w położeniu osiowym i z innym atomem w położeniu równikowym. Kolejne wiązania węgiel-wodór są przesunięte, co minimalizuje naprężenia skręcające pierścienia.
Drugą stabilną konformacją cząsteczki cykloheksanu jest konformacja typu twist-boat . Jeśli udział cząsteczek cykloheksanu w tej konformacji wynosi tylko około 0,1% w 25 ° C, to osiąga 30% w 800 ° C. Nagłe ochłodzenie próbki umożliwia następnie „zamrożenie” konformacji różnych cząsteczek. Konformacja skręconej łodzi jest mniej stabilna niż konformacja krzesła i dlatego nie jest zbyt powszechna w naturze. Możemy zauważyć przypadek twistanu , syntetycznego izomeru adamantanu , którego wszystkie cykloheksany mają konformację skręconej łodzi.
Odwrócenie budowy krzesła
W rzeczywistości istnieją dwie różne konformacje krzeseł, a cząsteczka cykloheksanu może zmienić konformację równowagi między tymi dwoma formami. Atomy wodoru w pozycji osiowej w konformacji jednego krzesła znajdują się w pozycji równikowej w drugiej i odwrotnie. Te dwie konformacje krzeseł znajdują się w szybkiej równowadze w temperaturze pokojowej i dlatego nie można ich odróżnić za pomocą protonowego NMR w temperaturze 25 ° C. Szczegółowy mechanizm inwersji konformacji krzeseł był przedmiotem wielu badań i debat, ale jest znany dzisiaj.
Znany jest również profil energetyczny inwersji konformacji krzesła. Konformacja półkrzesła jest stanem przejściowym umożliwiającym osiągnięcie pierwszej konformacji skręconej łodzi, a konformacja łodzi jest stanem przejścia między dwoma konformacjami skręconej łodzi. Energia aktywacji inwersji konformacji krzesła wynosi 43 kJ / mol, czyli jest niższa niż energia mieszania termicznego w temperaturze 25 ° C: dlatego te dwie konformacje krzesła są w równowadze w temperaturze otoczenia.
Większość konformacji podstawionych pochodnych cykloheksanu
Monopodstawione pochodneDwie konformacje krzeseł cykloheksanu mają tę samą energię. Z drugiej strony, jeśli atom wodoru zostanie zastąpiony podstawnikiem, te dwie konformacje nie mają już takiej samej energii. W konformacji krzesła podstawnik znajduje się w położeniu osiowym, podczas gdy w drugim jest w położeniu równikowym. W położeniu osiowym podstawnik powoduje dyskomfort przestrzenny z pozostałymi dwoma atomami wodoru w położeniu osiowym: te oddziaływania nazywane są interakcjami 1,3-dwuosiowymi. W pozycji równikowej interakcje te nie istnieją: jest to zatem konformacja krzesła, w której podstawnik znajduje się w pozycji równikowej, która ma niższą energię. Różnica w wolnej entalpii między tymi dwoma konformacjami krzeseł nazywana jest czynnikiem A i silnie zależy od podstawnika. Wartość A waha się od prawie zera dla małych podstawników, takich jak deuter, do około 21 kJ / mol dla dużych podstawników, takich jak grupa tert-butylowa.
Dipodstawione pochodneWeź pod uwagę, że dwa podstawniki znajdują się we względnych pozycjach 1, 2 lub 1, 4. Jeśli są w konfiguracji cis , obie konformacje krzeseł mają jedną grupę w pozycji osiowej, a drugą w pozycji równikowej: dwie konformacje krzeseł mają wtedy tę samą energię. Z drugiej strony, jeśli dwa podstawniki są w konfiguracji trans , tylko konformacja krzesła mająca dwie grupy w pozycji równikowej może istotnie istnieć, ponieważ silne oddziaływania 1,3-dwuosiowe uniemożliwiają obu grupom ustawienie osiowe równocześnie.
Weź pod uwagę, że dwa podstawniki znajdują się teraz we względnych pozycjach 1,3. Jeśli są w konfiguracji cis , przypadek jest podobny do konfiguracji trans dla podstawników we względnej pozycji 1, 2 lub 1, 4. I odwrotnie, jeśli są w konfiguracji trans , przypadek jest podobny do konfiguracji cis dla podstawników we względnej pozycji 1, 2 lub 1, 4.
Jeśli podstawniki są bardzo obszerne, konformacja krzesła może nie być najbardziej stabilna: w przypadku cis -1,4-di-tert-butylocykloheksanu konformacja skręconej łodzi umożliwia umieszczenie dwóch grup w korzystniejszej pozycji niż dla konformacji krzesła, dla której grupa tert-butylowa jest w pozycji osiowej. Zatem za pomocą NMR zmierzono, że konformacja skręconej łodzi była bardziej stabilna o 0,47 kJ / mol przy 125 K niż konformacja krzesła.
Analogi heterocykliczne
Heterocykliczne analogi cykloheksanu są wszechobecne m.in. w dziedzinie cukrów , piperydyn czy dioksanów . Konformacja krzesła jest na ogół najbardziej stabilna, ale wartości czynnika A różnią się znacznie przy zastępowaniu grupy metylenowej atomem tlenu lub azotu, o czym świadczy efekt anomeryczny . Możemy również zauważyć pewne analogi heterocykliczne, takie jak 1,2,4,5-tetratian (SCH 2 S) 2, dla których interakcje 1,3-dwuosiowe nie istnieją: o wiele więcej cząsteczek ma wówczas konformację skręconej łodzi. W przypadku analogu tetrametylowego, 3,3,6,6-tetrametylo-1,2,4,5-tetrathianu, konformacją dominującą jest konformacja skręconej łodzi.
Toksyczność i ryzyko
Toksyczność
Ze względu na toksyczność cykloheksanu istnieją wartości graniczne ekspozycji mające na celu ochronę osób pracujących z tym związkiem:
- od 300 do 375 ppm we Francji, w zależności od czasu ekspozycji,
- 200 ppm w Niemczech,
- 100 ppm w Stanach Zjednoczonych.
Palność
Cykloheksan jest bardzo łatwopalny. Wyciek cykloheksanu w brytyjskiej fabryce we Flixborough spowodował eksplozję w 1974 r., W której zginęło 28 osób pracujących na miejscu.
Uwagi i odniesienia
- cykloheksan , karty charakterystyki (y) Międzynarodowego Programu na bezpieczeństwie Substancji Chemicznych , konsultowany w dniu 9 maja 2009
- (w) Hyp Daubensee J., Jr. , James D. Wilson and John L. Laity, „ diamagnetic Susceptibility Exaltation in Hydrocarbons ” , Journal of the American Chemical Society , tom. 91 N O 8,9 kwietnia 1968, s. 1991-1998
- obliczona masa cząsteczkowa od „ atomowych jednostek masy elementów 2007 ” na www.chem.qmul.ac.uk .
- "" cykloheksanu w substancjach niebezpiecznych Data Bank , dostępnym 05 maja 2010
- (w) Iwona Owczarek i Krystyna Błażej, „ Zalecane temperatury krytyczne. Część druga. Aromatic and Cyclic Hydrocarbons ” , J. Phys. Chem. Nr ref. Dane , vol. 33 N O 230 kwietnia 2004, s. 541 ( DOI 10.1063 / 1.1647147 )
- (w) James E. Mark, Physical Properties of Polymer Handbook , Springer,2007, 2 II wyd. , 1076, s. ( ISBN 978-0-387-69002-5 i 0-387-69002-6 , czytaj online ) , str. 294
- (w) JG Speight, Norbert Adolph Lange, Lange's Handbook of Chemistry , Nowy Jork, McGraw-Hill ,2005, 16 th ed. , 1623 s. ( ISBN 978-0-07-143220-7 , LCCN 84643191 ) , str. 2,289
- (en) Robert H. Perry i Donald W. Green , Perry's Chemical Engineers 'Handbook , USA, McGraw-Hill ,1997, 7 th ed. , 2400 s. ( ISBN 978-0-07-049841-9 , LCCN 96051648 ) , str. 2-50
- „ Properties of Various Gases ” na stronie flexwareinc.com (dostęp 12 kwietnia 2010 )
- (w) William M. Haynes , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press / Taylor and Francis,1 st lipca 2010, 91 th ed. , 2610 s. ( ISBN 9781439820773 , prezentacja online ) , str. 14-40
- (w) Carl L. Yaws, Podręcznik diagramów termodynamicznych: związki organiczne C5 do C7 , t. 2, Huston, Teksas, Gulf Pub. Współ.,1996, 400 pkt. ( ISBN 978-0-88415-858-5 , LCCN 96036328 )
- Numer indeksu w tabeli 3.1 załącznika VI do rozporządzenia WE nr 1272/2008 (16 grudnia 2008)
- „ cykloheksan ” w bazie danych chemikaliów Reptox z CSST (Quebec organizacji odpowiedzialnej za bezpieczeństwo i higienę pracy), dostęp 24 kwietnia 2009
- Cykloheksan w witrynie ChemIDplus
- „ Cyclohexane ”, na hazmap.nlm.nih.gov (dostęp 14 listopada 2009 )
- M. Piraux, Static organic chemistry , Office international de librairie, Bruksela, str. 35 ( ISBN 978-2-87343-001-6 )
- (w) EW Warnhoff , „ Ciekawie splecione historie benzenu i cykloheksanu ” , Journal of Chemical Education , vol. 73, n o 6,Czerwiec 1996, s. 494 ( ISSN 0021-9584 i 1938-1328 , DOI 10.1021 / ed073p494 , czytaj online , dostęp 19 kwietnia 2020 )
- Bertholet (1867) „Nowe zastosowania metod redukcji w chemii organicznej” , Biuletyn Towarzystwa Chemicznego w Paryżu , seria 2, 7 : 53-65.
- Bertholet (1868) „Uniwersalna metoda redukcji i nasycania związków organicznych wodorem”, Bulletin de la Société Chimique de Paris , seria 2, 9 : 8-31
- Adolf Baeyer (1870) „Ueber die Reduction aromatischer Kohlenwasserstoffe durch Jodphosphonium” (O redukcji związków aromatycznych przez jodek fosfoniowy [H 4 IP]), Annalen der Chemie und Pharmacie , 155 : 266–281
- Fred Fan Zhang, Thomas van Rijnman, Ji Soo Kim, Allen Cheng „O obecnych metodach uwodornienia związków aromatycznych, od 1945 do współczesności” Lunds Tekniska Högskola 2008
- Ceresana, „ Benzene - Study: Market, Analysis, Trends 2021 - Ceresana ” [ archiwum z 21 grudnia 2017 r] , na www.ceresana.com (dostęp: 4 maja 2018 )
- (in) Michael Tuttle Musser , „Cyclohexanol and Cyclohexanone” w Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH Verlag GmbH & Co. KGaA,15 czerwca 2000( ISBN 978-3-527-30673-2 , DOI 10.1002 / 14356007.a08_217 , czytaj online ) , a08_217
- (w) Cena DM, „ Kalibracja temperatury różnicowych kalorymetrów skaningowych ” , Journal of Thermal Analysis , obj. 45, n o 6,1995, s. 1285–1296 ( DOI 10.1007 / BF02547423 )
- Ta historia jest podsumowana tutaj: https://web.archive.org/web/20120228222221/https://webspace.yale.edu/chem125/125/history99/6Stereochemistry/Baeyer/Sachse.html Archived 02/28/2012 na maszynie Wayback
- (w) „ Odd Hassel - Biographical ” na nobelprize.org (dostęp: 20 kwietnia 2020 )
- (w) Gurvinder Gill , Mr. Diwakar Pawar and Eric A. Noe , „ Conformational Study of cis-1,4-Di-tert-butylcyclohexane by Dynamic NMR Spectroscopy and Computational Methods. Observation of Chair and Twist-Boat Conformations ” , The Journal of Organic Chemistry , t. 70 N O 26,grudzień 2005, s. 10726–10731 ( ISSN 0022-3263 i 1520-6904 , DOI 10.1021 / jo051654z , czytaj online , dostęp 20 kwietnia 2020 )
- INRS arkusz toksykologiczne nr 17 Dokumenty notebooki - Bezpieczeństwo i higiena pracy - N O 190, 1 st czwarta 2003
- Ministerstwo za środowiska - DPPR / SEI / BARPI N O 5611










