Trifluorek chloru
| Trifluorek chloru | |||
|
|||
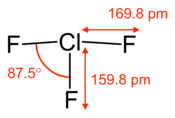
| Struktura trifluorku chloru. | |||
| Identyfikacja | |||
|---|---|---|---|
| N O CAS | |||
| N O ECHA | 100,029,301 | ||
| N O WE | 232-230-4 | ||
| N O RTECS | FO2800000 | ||
| PubChem | 24637 | ||
| ChEBI | 30123 | ||
| UŚMIECHY |
FCl (F) F , |
||
| InChI |
Std. InChI: InChI = 1S / ClF3 / c2-1 (3) 4 Stand. InChIKey: JOHWNGGYGAVMGU-UHFFFAOYSA-N |
||
| Wygląd | Żółtawy gaz lub ciecz | ||
| Właściwości chemiczne | |||
| Brute formula | ClF 3 | ||
| Masa cząsteczkowa | 92,448 ± 0,002 g / mol Cl 38,35%, F 61,65%, |
||
| Moment dwubiegunowy | 0,6 ± 0,1 D. | ||
| Właściwości fizyczne | |||
| T ° fuzja | -76,31 ° C | ||
| * Temperatura wrzenia | 11,8 ° C | ||
| Masa objętościowa | 3,57 kg · m -3 do 0 ° C i 101,3 kPa | ||
| Nasycenie prężności par | 141,9 kPa w 20 ° C | ||
| Punkt krytyczny | 174,0 ° C ; 5,78 MPa ; 0,548 g · cm -3 | ||
| Potrójny punkt | -76,3 ° C | ||
| Termochemia | |||
| Δ vap H ° | 27,53 kJ · mol -1 ( 1 atm , 11,75 ° C ) | ||
| Środki ostrożności | |||
| SGH | |||
    Niebezpieczeństwo H270, H280, H314, H330, H370, H372, H400, H270 : Może spowodować lub intensyfikować pożar; utleniacz H280 : Zawiera gaz pod ciśnieniem; ogrzanie grozi wybuchem H314 : Powoduje poważne oparzenia skóry i uszkodzenia oczu H330 : Wdychanie grozi śmiercią H370 : Powoduje uszkodzenie narządów (lub wymienić wszystkie narządy dotknięte chorobą, jeśli są znane) (podać drogę narażenia, jeżeli definitywnie udowodniono, że nie ma innej drogi) narażenia prowadzi do tego samego zagrożenia) H372 : Wykazane ryzyko poważnego uszkodzenia narządów (wskazać wszystkie narządy dotknięte chorobą, jeśli są znane) w następstwie powtarzanego lub przedłużonego narażenia (wskazać drogę narażenia, jeżeli definitywnie udowodniono, że żadna inna droga narażenia nie powoduje to samo zagrożenie) H400 : Działa bardzo toksycznie na organizmy wodne |
|||
| Transport | |||
265 : trujący i utleniający gaz (sprzyja pożarowi) Numer UN : 1749 : TRIFLUOREK CHLORU Klasa: 2.3 Etykiety: 2.3 : Gazy toksyczne (odpowiadają grupom oznaczonym przez duże T, tj. T, TF, TC, TO, TFC i TOC). 5.1 : Substancje utleniające 8 : Substancje żrące Opakowanie: -    |
|||
| Jednostki SI i STP, chyba że określono inaczej. | |||
Trifluorek chloru jest interhalogen o wzorze clf 3. Jest to bezbarwny, silnie utleniający i niezwykle reaktywny, korozyjny i toksyczny gaz, który skrapla się do postaci zielonkawożółtej cieczy. Najczęściej występuje na rynku w postaci płynnej pod ciśnieniem w temperaturze pokojowej. Jest stosowany głównie w fazach czyszczenia i do wytrawiania chemicznego w przemyśle półprzewodników oraz w niektórych innych procesach przemysłowych. Jest stosowany w szczególności w jądrowym cyklu paliwowym , gdzie umożliwia konwersję nielotnych fluorowanych związków uranu w sześciofluorek uranu UF 6związek o ciekawych właściwościach fizycznych z punktu widzenia procesów wzbogacania uranu :
Jego użycie jako utleniacza do napędu kosmicznego zostało obecnie porzucone, biorąc pod uwagę rzeczywiste zagrożenie dla sprzętu i załóg; z drugiej strony jest surowcem do syntezy pentafluorku chloru ClF 5, paliwo używane czasami, najczęściej z hydrazyną , do napędu niektórych pocisków.
Przygotowanie i właściwości
Trójfluorek chloru został po raz pierwszy przygotowany w 1931 roku przez dwóch niemieckich chemików O. Ruffa i H. Kuga w reakcji fluoru F 2na chlorze Cl 2, który również wytwarzał monofluorek chloru ClF, oddzielany od trifluorku przez destylację:
3 F 2+ Cl 2→ 2 ClF 3Cząsteczka ClF 3ma kształt litery T, co teoria VSEPR dobrze wyjaśnia:
- atom chloru znajduje się w środku cząsteczki
- jednym z trzech położeń równikowej jest zajęta przez fluor atomem związany chloru przez kowalencyjne wiązanie
- pozostałe dwie pozycje równikowe są zajęte przez niewiążący dublet
- każde z dwóch położeń osiowych jest zajęte przez atom fluoru tworzący, z centralnym atomem chloru , wiązanie z trzema centrami i czterema elektronami , zwykle prostoliniowe, ale tutaj nieco pofałdowane pod wpływem dwóch niewiążących dubletów.
Trzy atomy fluoru są zatem połączone z chlorem wiązaniami różnego typu, co skutkuje różnymi długościami wiązań:
- ~ 159,8 µm dla równikowego ( kowalencyjnego ) wiązania Cl-F
- ~ 169,8 pm dla wiązań osiowych Cl-F (uczestniczących w wiązaniu 3c-4e )
Czysty trifluorek chloru jest stabilny do 180 ° C , ale rozkłada się do F 2i Cl 2 powyżej tej temperatury.
Jest bardzo energicznym utleniaczem, a także środkiem fluorującym. Bardzo reaktywny z większością materii organicznej i mineralnej, może powodować samorzutne, czasem wybuchowe spalanie. Metalu zwykle podać chlorki i fluorki , fosforu daje trichlorek fosforu PCl 3i pięciofluorek fosforu PF 5podczas gdy siarka daje dichlorek siarki SCl 2a także czterofluorek siarki SF 4. W temperaturze pokojowej, siarkowodór H 2 Swybucha w kontakcie z trifluorkiem chloru, który również gwałtownie hydrolizuje w kontakcie z wodą H 2 Ouwalniając zestaw niebezpiecznych związków, zaczynając od fluorowodoru HF.
Ryzyka
Ponieważ trifluorek chloru jest bardziej utleniający niż sam tlen , może powodować korozję ceramiki, a także różnych materiałów opartych na tlenkach nieorganicznych, które często uważa się za niepalne, w tym beton. Wszystko, co wchodzi w kontakt z ClF 3 należy starannie wyselekcjonować i oczyścić z wszelkich zanieczyszczeń, które mogłyby spowodować wybuchowe spalanie.
W kontakcie ze skórą trójfluorek chloru może wywołać spalanie żywej tkanki, jeśli jest w wystarczającej ilości. Hydrolizuje, atakując komórki, w bardzo egzotermicznej reakcji, która powoduje zarówno oparzenia termiczne, jak i chemiczne, w szczególności przez kwas fluorowodorowy uwalniany w tkankach w wyniku tej hydrolizy. Kwas ten jest ponadto toksyczny, więc zatrucie metaboliczne przyczynia się do fizjologicznej degradacji spowodowanej jego kwaśnym charakterem.
Uwagi i odniesienia
- (w) David R. Lide, Podręcznik chemii i fizyki , Boca Raton, CRC, 16 czerwca 2008, 89 th ed. , 2736 str. ( ISBN 978-1-4200-6679-1 i 1-4200-6679-X ) , str. 9-50.
- obliczona masa cząsteczkowa od „ atomowych jednostek masy elementów 2007 ” na www.chem.qmul.ac.uk .
- Wpis „Chlorotrifluoride” w bazie danych chemikaliów GESTIS IFA (niemieckiego organu odpowiedzialnego za bezpieczeństwo i higienę pracy) ( niemiecki , angielski ), dostęp 27 maja 2018 r. (Wymagany JavaScript)
- (w) David R. Lide, CRC Handbook of Chemistry and Physics , CRC Press, 2009, 90 th ed. , 2804 s. , Twarda oprawa ( ISBN 978-1-4200-9084-0 ).
- (w) Hitoshi Habuka Takahiro Sukenobu, Hideyuki Koda, Takashi Takeuchi i Masahiko Aihara, „ Silicon Etch Rate Using Chlorine Trifluoride ” , Journal of the Electrochemical Society , tom. 151 n O 112004, G783 - G787 ( DOI 10.1149 / 1.1806391 ).
- Patent Stanów Zjednoczonych 5849092 „Proces czyszczenia komory trifluorku chloru” .
- Patent Stanów Zjednoczonych 6034016 „Metoda regeneracji halogenowanych katalizatorów stanowiących kwas Lewisa” .
- ( BEST) Board on Environmental Studies and Toxicology , Acute Exposure Guideline Levels for Selected Airborne Chemicals: Tom 5 http: //books.nap.edu/catalog.php?record_id=11774 (cytat z National Academies Press) , Waszyngton, National Academies Press ,2006, 267 s. , kieszeń ( ISBN 978-0-309-10358-9 , LCCN 2002275572 ) , s. 40.
- szczególnie niektóre międzykontynentalne pociski balistyczne , które generalnie używają ciekłych materiałów pędnych z kilkoma wyjątkami, takimi jak, jak się wydaje, nowy izraelski Jericho-3.
- (w) Otto Ruff , H. Krug, „ Über ein neues Chlorfluorid CIF- 3 ” , Zeitschrift für anorganische und allgemeine Chemie , vol. 190 n o 1,1931, s. 602–608 ( DOI 10.1002 / zaac.19301900127 ).