Reakcja Wohla-Zieglera
Wohl-Zieglera lub bromujący Wohl-Zieglera , nazwany niemieckich chemików Alfred Wohla a Karl Ziegler , jest reakcją rodnik podstawienie prowadzi do bromowania allilowych lub benzylowe węglowodoru za pomocą N -bromoimide z inicjatora rodnikowego (tradycyjnie AIBN lub nadtlenek benzoilu ), albo za napromieniowanie .
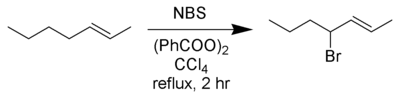
Najlepsze wydajności tej reakcji uzyskano stosując N -bromosukcynimid (NBS) w roztworze w CCl 4bezwodny. Rodniki allilowe i benzylowe powstałe podczas reakcji są trwalsze niż inne rodniki węglowe, a dominującymi produktami są bromki allilu i benzylu.
Realizacja
Typową realizacją tej reakcji jest dodanie stechiometrycznej ilości N -bromosukcynimidu i niewielkiej ilości inicjatora do roztworu substratu w CCI4 ., następnie mieszaninę miesza się i doprowadza do wrzenia. O rozpoczęciu reakcji świadczy bardziej energiczne gotowanie, czasami wymuszające zatrzymanie ogrzewania. Gdy cały N -bromosukcynimid (gęstszy niż rozpuszczalnik) zostanie przekształcony w sukcynimid (który unosi się w rozpuszczalniku), reakcja kończy się.
Medium musi pozostać całkowicie bezwodne przez całą reakcję, a pożądany produkt łatwo ulega hydrolizie . Węglan baru jest często stosowany do utrzymania tych bezwodnych warunkach, nie kwasowe.
Mechanizm reakcji
Przedstawiony tu mechanizm dotyczy bromowania cykloheksenu .
Inicjacja:

- Reakcja rodnika z NBS i powstanie rodnika bromu
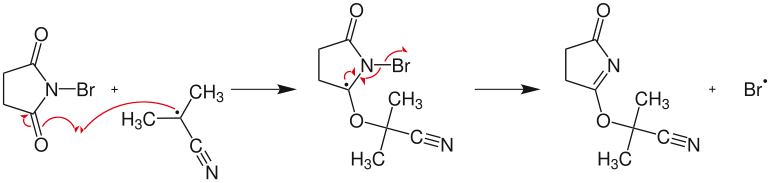
Propagacja łańcucha:
- Radykalna reakcja pomiędzy rodnikiem bromu i cykloheksenem z wytworzeniem bromowodoru i rodnika cykloheksenylowego:

- Reakcja pomiędzy NBS tworzącym sukcynimid i włókniakiem

- Radykalne dodanie bromu do cykloheksenylu w celu wytworzenia produktu końcowego ( bromocykloheksenu ) z regeneracją rodnika bromu umożliwiającego ponowne uruchomienie mechanizmu łańcuchowego:

Regioselektywność
Reakcja Wohla-Zieglera preferencyjnie bromuje najbardziej zatłoczone położenie, jeśli substrat ma kilka pozycji allilowych. Ta regioselektywność odpowiada tworzeniu najbardziej ustabilizowanego rodnika.
Gdy cząsteczka ma pierścień aromatyczny , reakcja Wohla-Zieglera tworzy wyłącznie produkt bromowania pozycji benzylowej , bez bromowania pierścienia.
Uwagi i odniesienia
- (De) A. Wohl , " Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge " , Ber. Dtsch. Chem. Ges. , vol. 52, n o 1,1919, s. 51-63 ( ISSN 0009-2940 , DOI 10.1002 / cber.19190520109 ).
- (De) K. Ziegler , „ Die Synthese des Cantharidins ” , Liebigs Ann. Chem. , vol. 551 n o 1,1942, s. 1-79 ( ISSN 0075-4617 , DOI 10.1002 / jlac.19425510102 ).
- (in) FL Greenwood i MD Kellert , „ 4-bromo-2-heptene ” , Org. Synth. , vol. 58,1958, s. 8 ( ISSN 0078-6209 , DOI 10.15227 / orgsyn.038.0008 ).
- (w) C. Djerassi , „ Brominacje z N-bromosukcynimidem i związkami pokrewnymi. The Wohl-Ziegler Reaction ” , Chem. Obrót silnika. , vol. 43 N O 21948, s. 271–317 ( ISSN 0009-2665 , DOI 10.1021 / cr60135a004 ).
- (De) L. Horner i EM Winkelman , „ Neuere Methoden der präparativen organischen Chemie II 14. N-Bromsuccinimid, Eigenschaften und Reaktionsweisen Studien zum Ablauf der Substitution XV ” , Angew. Chem. , vol. 71 N O 111959, s. 349–365 ( ISSN 1433-7851 , DOI 10.1002 / ange.19590711102 ).
- (in) RW Binkley i GS Goewey , „ wybrano regioselektywne otwarcie pierścienia acetali benzylidenowych. A fotochemicznie zapoczątkowana reakcja częściowego odbezpieczenia węglowodanów ” , J. Org. Chem. , vol. 49, n o 6,1984, s. 992–996 ( ISSN 0022-3263 , DOI 10.1021 / jo00180a008 ).
- Kürti i Czakó 2005 , s. 492
- (en) / (de) Ten artykuł jest częściowo lub w całości zaczerpnięty z artykułów zatytułowanych w języku angielskim „ Wohl-Ziegler bromination ” ( patrz lista autorów ) oraz w języku niemieckim „ Wohl-Ziegler-Reaktion ” ( patrz lista autorów ) .
Bibliografia
- (en) László Kürti i Barbara Czakó , Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanism , Amsterdam, Elsevier Academic press,2005, 758 str. ( ISBN 0-12-429785-4 )