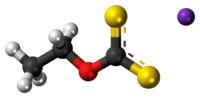
Etyloksantogenian potasu
| Etyloksantogenian potasu | |||
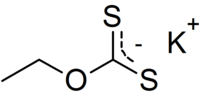
| |||
 | |||
| Identyfikacja | |||
|---|---|---|---|
| Nazwa systematyczna | O-etylokarbonoditionian potasu | ||
| N O CAS | |||
| N O ECHA | 100,004,946 | ||
| PubChem | 2735045 | ||
| UŚMIECH |
[K +] [S-] C (= S) OCC , |
||
| InChI |
Stand. InChI: InChI = 1S/C3H6OS2.K/c1-2-4-3 (5) 6;/h2H2,1H3, (H,5,6);/q;+1/p-1 Std. InChIKey: JCBJVAJGLKENNC-UHFFFAOYSA-M |
||
| Wygląd | żółty proszek, nieprzyjemny zapach | ||
| Właściwości chemiczne | |||
| Formuła |
C 3 H 5 K O S 2 |
||
| Masa cząsteczkowa | 160,3 ± 0,013 g / mol C 22,48%, H 3,14%, K 24,39%, O 9,98%, S 40,01%, |
||
| Właściwości fizyczne | |||
| T ° fuzja | 209 do 210 ° C ( rozkład ) | ||
| Rozpuszczalność | 1090 g · L -1 (woda, 20 °C ) | ||
| Środki ostrożności | |||
| SGH | |||
  H228, H302, H315, H319, H332, H335, EUH018, P210, P260, P305 + P351 + P338,
H228 : Substancja stała łatwopalna
H228, H302, H315, H319, H332, H335, EUH018, P210, P260, P305 + P351 + P338,
H228 : Substancja stała łatwopalna H302 : Działa szkodliwie po połknięciu H315 : Działa drażniąco na skórę H319 : Działa drażniąco na oczy H332 : Działa szkodliwie w następstwie wdychania H335 : Może powodować podrażnienie dróg oddechowych EUH018 : Podczas stosowania może tworzyć palną/wybuchową mieszaninę para-powietrze P210 : Przechowywać z dala od ciepło / iskry / otwarty ogień / gorące powierzchnie. - Zakaz palenia. P260 : Nie wdychać pyłu/dymu/gazu/mgły/par/rozpylonej cieczy. P305 + P351 + P338 : W przypadku dostania się do oczu: Ostrożnie płukać wodą przez kilka minut. Usuń soczewki kontaktowe, jeśli poszkodowany je nosi i można je łatwo usunąć. Kontynuuj płukanie. |
|||
| Transport | |||
40 : palne ciało stałe lub samoreaktywne lub samonagrzewające się Numer UN : 3342 : KANTANATY Klasa: 4.2 Nalepka: 4.2 : Substancje podatne na samozapłon  |
|||
| Ekotoksykologia | |||
| DL 50 |
308 mg · kg -1 (mysz, doustnie ) 199 mg · kg -1 (myszy, iv ) 500 mg · kg -1 (myszy, ip ) 1700 mg · kg -1 (szczur, doustnie ) |
||
| Jednostki SI i STP, chyba że zaznaczono inaczej. | |||
Etyloksantogenianu potasu jest związkiem siarkoorganiczne z rodziny ksantogeniany (ditiowęglany) o wzorze CH 3 CH 2 SCO 2 K. jest on stosowany w przemyśle górniczym jako środek flotacyjnego do oddzielania rud . W przeciwieństwie do ksantogenianu sodu , sól potasowa występuje w stanie bezwodnym.
Nieruchomości
Etyloksantogenian potasu występuje w postaci żółtego proszku o nieprzyjemnym zapachu. Jest stabilny przy wysokim pH, ale szybko ulega hydrolizie do pH poniżej 9, do 25 °C . W przeciwieństwie do swojego odpowiednika sodowego, krystalizuje do bezwodnej soli i nie jest higroskopijny . Etyloksantogenian potasu jest związkiem palnym. Rozkłada się w temperaturze około 210 ° C , zanim stanie się zdolny do stopienia, uwalniając dwusiarczek węgla , wysoce łatwopalny (temperatura samozapłonu 90 ° C ).
Synteza
Etyloksantogenian potasu został po raz pierwszy zsyntetyzowany w 1822 roku przez duńskiego chemika Williama Christophera Zeise'a z wodorotlenku potasu , dwusiarczku węgla i etanolu . Ta metoda jest stosowana do dziś: jest to reakcja między alkoholanem , tutaj etanolanem, a dwusiarczkiem węgla, w wyniku której powstaje ksantogenian. Alkoholan powstaje in situ w wyniku reakcji alkoholu (tutaj etanol) z mocną zasadą (tutaj wodorotlenek potasu):
CH 3 CH 2 OH + CS 2 + KOH → CH 3 CH 2 OCS 2 K + H 2 OAplikacje
Etyloksantogenianu potasu stosowany jest w przemyśle górniczym jako środek flotacyjnego do oddzielania rud z miedzi , niklu i srebra . Metoda ta wykorzystuje powinowactwo tych „ miękkich ” metali z ligandem organosiarczkowym.
Etyloksantogenian potasu jest użytecznym odczynnikiem do wytwarzania tioketonów w reakcji z dichlorkami, ale także estrów ksantogenianowych z halogenków alkilowych i arylowych . Estry te są następnie użytecznymi półproduktami w syntezie organicznej .
Etyloksantan potasu zostało zbadane jako środek konserwujący , w reagent wytrącania, w Japonii do ekstrakcji ciecz-ciecz z technetu i renu .
Uwagi i referencje
- (en) / (de) Ten artykuł jest częściowo lub w całości zaczerpnięty z artykułów zatytułowanych w języku angielskim „ Ksantynian etylowy potasu ” ( patrz lista autorów ) oraz w języku niemieckim „ Kalium-O-ethyldithiocarbonat ” ( patrz lista autorów ) .
- Wpis „Potassium O-ethyl dithiocarbonate” w chemicznej bazie danych GESTIS IFA (niemiecki organ odpowiedzialny za bezpieczeństwo i higienę pracy) ( niemiecki , angielski ), dostęp 30 września 2019 r. (wymagany JavaScript)
- obliczona masa cząsteczkowa od „ atomowych jednostek masy elementów 2007 ” na www.chem.qmul.ac.uk .
- Gigiena Truda i Professional'nye Zabolevaniya. Higiena pracy i choroby zawodowe. Lot. 29 (11), str. 51, 1985.
- Chvapil M, Zahradnik R, Cmuchalova B., „ Wpływ alkoholi i soli potasowych kwasów ksantogenicznych na różne obiekty biologiczne. », Archives Internationales de Pharmacodynamie et de Therapie , t. 135,Luty 1962, s. 330-343 ( PMID 13879442 )
- Domer FR, Schuler FW., „ Ochrona przed promieniowaniem rentgenowskim niektórych związków sulfhydrylowych i ich prekursorów u myszy. », Archives Internationales de Pharmacodynamie et de Therapie , t. 127,sierpień 1960, s. 128-131 ( PMID 13723622 )
- Gigiena i Sanitariya. Aby uzyskać tłumaczenie na język angielski, zobacz HYSAAV. Lot. 41 (6), str. 95, 1976.
- (de) Wpis Kaliumdithiocarbonate na Römpp Online . Georg Thieme Verlag, konsultacja 30 maja 2014 r.
- Charles C. Price i Gardner W. Stacy, siarczek p-nitrofenylu , Org. Syntezator. 28 , kol. lot. 3",1948, 82 s. , s. 667
- Kathrin-Maria Roy, „Xanthates” , w Encyklopedii Chemii Przemysłowej Ullmanna , Weinheim,2005( DOI 10.1002 / 14356007.a28_423 )
- Alexander Schönberg i Emil Frese, „ Organische Schwefelverbindungen, LIV. Synthesen von Thiocarbonylverbindungen durch Einwirkung von Kaliumxanthogenat oder Thioharnstoffen auf gem. Dichloride ”, Chemische Berichte , tom. 101 n O 2Luty 1968, s. 701-715 ( ISSN 0009-2940 , DOI 10.1002 / cber.19681010241 )
- Fabien Gagosz i Samir Z. Zard, A Xanthate-Transfer Approach to α-Trifluoromethylamines , Org. Syntezator. 84 , Dz. lot. 11",1948, 32 pkt. , s. 212