Reakcja Kulinkowicza
Reakcji kulinkovich się reakcji cyklopropanowania z estrów karboksylowych czołowych diastereoselectively do cyclopropanols .

Wersja stechiometryczna
Pierwsze przykłady reakcji Kulinkovicha , opisane w 1989 r., Wykorzystywały stechiometryczną ilość tetraizopropyloksytytanu. Aby uzyskać dobre wydajności, potrzebne były trzy równoważniki odczynnika Grignarda .
Wersja katalityczna
W 1991 roku Kulinkovich wykazał, że katalityczna ilość tetraizopropyloksytytanu jest wystarczająca do uzyskania dobrych wydajności. Okazało się nawet, że w tych warunkach można zmniejszyć zadeklarowaną ilość odczynnika Grignarda do dwóch równoważników.
Asymetryczna wersja reakcji Kulinkowicza
Ponieważ reakcja Kulinkovicha była katalityczna w tytanie, Corey i jego zespół wydali jej asymetryczną wersję. Uzyskali nadmiary enancjomeryczne do 78% stosując ligand typu Taddol.
Mechanizm
Powszechnie wywoływane mechanizm obejmuje pierwszy z dwóch kolejnych etapów transmetalacji z odczynnikiem Grignarda prowadzi, co prowadzi do złożonego dialkyldiisopropyloxytitane pośrednika. To ulega dysproporcjonowaniu, dając cząsteczkę alkanu i tytanacyklopropan 1 . Wprowadzenie estru karbonylowego do najczystszego wiązania węgiel - tytan tego gatunku powoduje przegrupowanie oksatytanacyklopentanu 2 w keton 3 . Wreszcie, wprowadzenie grupy karbonylowej 3 do resztkowego wiązania węgiel-tytan zamyka cyklopropan. W stanie przejściowym tego elementarnego etapu, który jest ograniczającym etapem reakcji, w celu wyjaśnienia obserwowanej diastereoselektywności przywołano stabilizujące agostyczne oddziaływanie między wodorem w grupie α grupy R2 a atomem tytanu . Otrzymany kompleks 4 jest tetraalkiloksytytanem zdolnym do odgrywania roli analogicznej do roli wyjściowego tetraizopropyloksytytanu, który zamyka cykl katalityczny . Pod koniec reakcji, żądany produkt występuje głównie w postaci z magnezu alkoholanu 5 , dając cyklopropanolu w czasie hydrolizy w środowisku reakcji .

Mechanizm reakcji Kulinkowicza był przedmiotem obszernych obliczeń opublikowanych w 2001 roku. Niektóre punkty pozostają jednak niejasne i najprawdopodobniej mechanizm tej reakcji nie jest tak prosty. Kulinkovich zaproponował ostatnio pośrednie kompleksy tytanu typu „ zjadł ”.
Reakcje wymiany ligandów z olefinami
Już w 1993 roku zespół Kulinkovicha wykazał zdolność tytanacyklopropanów do wymiany ligandów z olefinami . Odkrycie to było ważne, ponieważ dało dostęp do bardziej sfunkcjonalizowanych cyklopropanoli, jednocześnie unikając wytwarzania odpowiedniego magnezu, którego co najmniej dwa równoważniki należało użyć, aby uzyskać dobre wydajności. Cha i jego zespół wprowadzili zastosowanie cyklicznych odczynników Grignarda, szczególnie odpowiednich do tych reakcji wymiany ligandów.
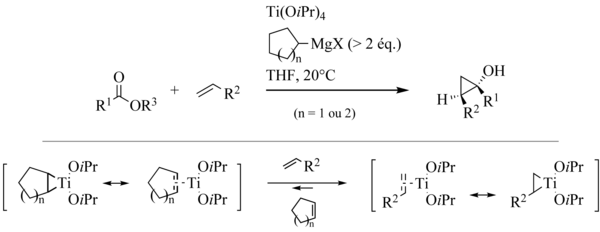
Reakcje wewnątrzcząsteczkowe Kulinkovicha
Ciekawe zastosowanie reakcji wymiany ligandów polega na przeprowadzaniu reakcji wewnątrzcząsteczkowych, począwszy od estrów pełniących funkcję olefin.
Powiązane reakcje
Opracowano kilka rozszerzeń reakcji Kulinkowicza :
- Kulinkovich-de Meijere reakcji , co prowadzi do aminocyclopropanes z amidów.
- reakcji Kulinkovich-Szymoniak , co prowadzi do aminocyclopropanes z nitryli.
- Patrz także: F. Sato, H. Urabe i S. Okamoto, Pure Appl. Chem. , 1999 , 71 , 1511-1519.
Źródła dalszych informacji
Na ten temat pojawiło się kilka szczegółowych artykułów:
- OG Kulinkovich i A. de Meijere, Chem. Obrót silnika. , 2000 , 100 , 2789–2834.
- F. Sato i in., Synlett , 2000 , 753–775.
- A. de Meijere, SI Kozhushkov and AI Savchenko in Titanium and Zirconium in Organie Synthesis (wyd .: I.Marek ), Wiley-VCH, Weinheim, 2002 , s. 390–434.
- OG Kulinkovich, Chem. Obrót silnika. , 2003 , 103 , 2597–2632.
- OG Kulinkovich, Russ. Chem. Bull., Int. Ed. , 2004 , 53 , 1065-1086.
- OG Kulinkovich, Eur. J. Org. Chem. , 2004 , 4517–4529.
- A. Wolan i Y. Six, Tetrahedron , 2010 , 66 , 15–61.
- A. Wolan i Y. Six, Tetrahedron , 2010 , 66 , 3097–3133.
Aby zapoznać się z trybem pracy z omówieniem, zobacz:
Uwagi i odniesienia
- OG Kulinkovich, SV Sviridov, DA Vasilevsky i TS Prityckaja, Zh. Org. Khim. , 1989 , 25 , 2244-2245.
- OG Kulinkovich, SV Sviridov i DA Vasilevski, Synthesis , 1991 , 234.
- EJ Corey, S. Achyutha Rao i Mark C. Noe, J. Am. Chem. Soc. , 1994 , 116 , 9345-9346.
- Y.–D. Wu i Z.-X. Yu, J. Am. Chem. Soc. , 2001 , 123 , 5777-5786.
- OG Kulinkovich i DG Kananovich, Eur. J. Org. Chem. , 2007 , 2121-2132.O.
- OG Kulinkovich, AI Savchenko, SV Sviridov i DA Vasilevski, Mendeleev Common. , 1993 , 230-231.
- J. Lee, H. Kim i JK Cha, J. Am. Chem. Soc. , 1996 , 118 , 4198-4199.
- A. Kasatkin i F. Sato, Tetrahedron Lett. , 1995 , 36 , 6079-6082.