Powietrze
| Powietrze | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| N O CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kod ATC | V03 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości chemiczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa cząsteczkowa | 28,965 g / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości fizyczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fuzja | −216,2 ° C ( 1 atm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * Temperatura wrzenia | -194,3 ° C ( 1 atm , +874,0 kg / m 3 ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rozpuszczalność | 0,0292 obj./obj. (Woda, 0 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
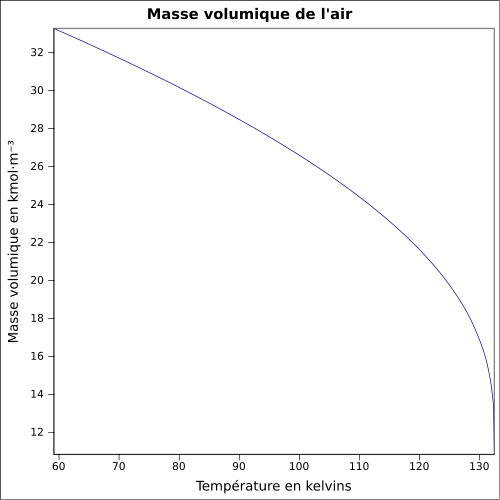
| Masa objętościowa |
1,2 kg / m 3 ( 21,1 ° C , 1 atm )
równanie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
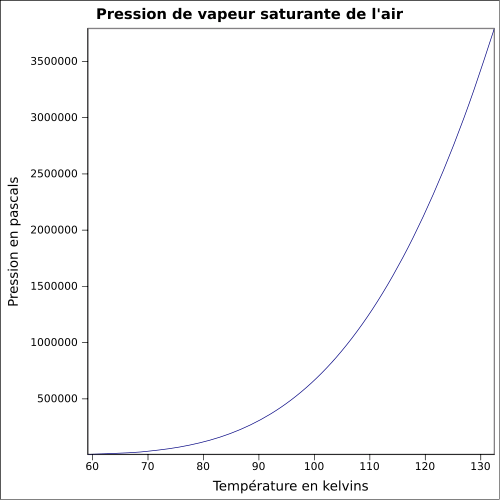
| Nasycenie prężności par |
równanie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punkt krytyczny | −140,6 ° C , 3771 kPa , 351 kg / m 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Przewodność cieplna | 0,023 4 W · m −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochemia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
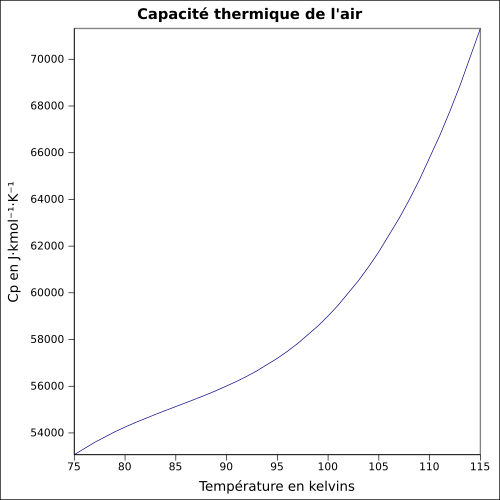
| C p |
równanie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości optyczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Współczynnik załamania światła | 1,00026825 ( 100 kPa , suche powietrze z 450 ppm CO 2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jednostki SI i STP, chyba że określono inaczej. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Powietrze jest mieszaniną gazów wchodzących w skład atmosfery ziemskiej . Zwykle jest bezbarwny, niewidoczny i bezwonny.
Kompozycja
Suche powietrze przy ziemi jest jednorodną mieszaniną gazów. Składa się w przybliżeniu z ułamka molowego lub objętości:
- 78,08% azotu ;
- 20,95% tlenu ;
- mniej niż 1% innych gazów, w tym:
- gazy szlachetne , głównie:
- z dwutlenku węgla (CO 2) ~ 0,04% (415 ppmv inKwiecień 2021),
- od metanu 0.000187% (1,87 ppmv w 2019 r).
Zawiera również śladowe ilości 0,000072% diwodoru (0,72 ppmv ), ale także ozon , a także minimalną obecność radonu . Może również zawierać dwutlenek siarki , tlenki azotu , drobne zawiesiny w postaci aerozolu , pył i mikroorganizmy.
Przez większość czasu powietrze w środowisku ziemskim jest wilgotne, ponieważ zawiera parę wodną . W pobliżu gruntu ilość pary wodnej jest bardzo zmienna. Zależy to od warunków klimatycznych, w szczególności od temperatury. Częściowe ciśnienie pary wodnej w powietrzu jest ograniczone przez jego ciśnienie pary nasyconej , która zmienia się znacznie wraz z temperaturą:
| Temperatura powietrza | -10 ° C | 0 ° C | 10 ° C | 20 ° C | 30 ° C | 40 ° C |
| % pary wodnej
dla ciśnienia powietrza 1013 hPa |
0 do 0,2% | 0 do 0,6% | 0 do 1,2% | 0 do 2,4% | 0 do 4,2% | 0 do 7,6% |
Procentowy udział pary wodnej w powietrzu mierzony jest wskaźnikiem wilgotności , jest to ważny element prognoz pogody. Istnieje kilka wielkości opisujących hydrometrię: wilgotność bezwzględna , która odpowiada masie pary wodnej na objętość powietrza; i wilgotność względną , która jest wartością procentową ciśnienia cząstkowego pary wodnej w stosunku do prężności pary nasyconej .
Poziom dwutlenku węgla zmienia się w czasie. Z jednej strony, to ulega zmianie rocznej około 6,5 ppmv ( s ekcja p ar m ln w V POZIOM GŁOŚNOŚCI) amplitudzie. Z drugiej strony średnia roczna stopa rośnie od 1,2 do 1,4 ppmv rocznie. Na poziomie 384 ppmv (0,0384%) w połowie 2008 r. Było to 278 ppmv przed rewolucją przemysłową , 315 ppmv w 1958 r., 330 ppmv w 1974 r. I 353 ppmv w 1990 r. Ta cieplarnia gazów cieplarnianych odgrywa ważną rolę w globalnym ociepleniu. planety.
Metan jest innym gazem głównym cieplarnianych, którego szybkość rośnie z czasem: 800 mm, 3 / m 3 (0,8 ppmv ) na wstępnie przemysłowej ery, 1585 mm, 3 / m, 3 1985, 1663 mm, 3 / m 3 , w 1992 roku, a 1676 mm, 3 / m 3 w 1996 roku.
Do wysokości około 80 km skład suchego powietrza jest bardzo jednorodny, jedyną znaczącą różnicą w składzie powietrza jest zawartość pary wodnej.
Skład powietrza
|
|
||||||||||||||||||||||||||||||||||||||||||||
Proporcje masowe można oszacować mnożąc proporcje objętościowe przez stosunek masy molowej rozpatrywanego gazu podzielonego przez masę molową powietrza, czyli 28,976 g mol −1 , na przykład w przypadku CO 2. Ten stosunek nie jest bez znaczenia, ponieważ wynosi 44 / 28,976 = 1,5185, stąd zawartość masowa CO 2w powietrzu równym 415 × 1,5185 = 630 ppmm .
Masa objętościowa
Ponieważ powietrze jest gazem ściśliwym, jego gęstość (w kg / m 3 ) jest funkcją ciśnienia, temperatury i wilgotności.
Dla suchego powietrza przy normalnym ciśnieniu atmosferycznym ( 1013,25 hPa ):
Ogólnie przyjmuje 1.293 kg / m 3 do 0 ° C i 1.204 kg / m 3 do 20 ° C .
Jest to uogólnione ( wzór na gaz idealny ) w: (z T w kelwinach i P w paskalach zgodnie z konwencjami SI). Dla temperatury θ w stopniach Celsjusza, temperaturę T w stopniach Celsjusza otrzymuje się przez dodanie 273,15 do θ : T (K) = θ (° C) + 273,15 .
Potencjał tworzenia efektu cieplarnianego
Współczynnik ocieplenia globalnego (GWP w języku angielskim : GWP: Global Warming Potential ) lub równoważny CO 2umożliwia pomiar „szkodliwości” każdego gazu cieplarnianego .
Poniższa tabela przedstawia wartość GWP dla głównych gazów cieplarnianych obecnych w powietrzu:
| PRG | 1 (odniesienie) | 8 | 23 | 310 | od 1300 do 1400 | od 6200 do 7100 | 6500 | 22,800 |
| gaz | dwutlenek węgla | para wodna | metan | podtlenek azotu (N 2 O) | chlorodifluorometan (HCFC) | dichlorodifluorometan (CFC) | czterofluorek węgla (CF 4 ) | sześciofluorek siarki (SF 6 ). |
Współczynnik załamania światła
Wyrażenie na współczynnik załamania światła powietrza „w warunkach normalnych” to:
z którym jest długość fali wyrażoną w nanometrach (nm), przy czym jest odwrotnością długości fali w mikrometrach.Przeznaczony jest do suchego powietrza z 0,03% dwutlenkiem węgla , pod ciśnieniem 101,325 Pa (760 milimetrów słupa rtęci) i temperaturze 288,15 kelwinów ( 15 ° C ).
Możemy otrzymać n dla innej temperatury lub ciśnienia, używając jednego z następujących dwóch wyrażeń:
z:
- T - temperatura wyrażona w kelwinach ;
- p , ciśnienie w paskalach;
- T s , 288,15 K ;
- p s , 101 325 Pa ;
- n s , współczynnik załamania światła powietrza podany powyżej,
lub:
z:
- T , temperatura w stopniach Celsjusza ;
- T s , 15 ° C ;
- p , ciśnienie w mmHg ;
- p s , 760 mmHg ;
- 0,00366 K- 1 ;
- , (1,049 - 0,015 T ) × 10-6 mmHg -1 ;
- , 8,13 × 10-7 mmHg- 1 ;
- n s , współczynnik załamania światła powietrza podany powyżej.
Właściwości termofizyczne
Z tabel opublikowanych przez Franka M. White'a, Heat and Mass transfer , Addison-Wesley, 1988.
z:
- T , temperatura w kelwinach ;
- ρ , gęstość ;
- μ , lepkość dynamiczna ;
- ν , lepkość kinematyczna ;
- C p , ciepło właściwe przy stałym ciśnieniu ;
- λ , przewodność cieplna ;
- a , dyfuzyjność cieplna ;
- Pr , liczba Prandtla .
| T | ρ | μ | ν | C p | λ | w | Pr |
|---|---|---|---|---|---|---|---|
| K. | kg m -3 | kg m −1 s −1 | m 2 s −1 | J kg −1 K −1 | W m −1 K −1 | m 2 s −1 | - |
| 250 | 1.413 | 1,60 x 10-5 | 0,949 x 10-5 | 1,005 | 0,0223 | 1,32 x 10-5 | 0,722 |
| 300 | 1.177 | 1,85 x 10-5 | 1,57 x 10-5 | 1,006 | 0,0262 | 2,22 x 10-5 | 0,708 |
| 350 | 0,998 | 2,08 x 10-5 | 2,08 x 10-5 | 1,009 | 0,0300 | 2,98 x 10-5 | 0.697 |
| 400 | 0.883 | 2,29 x 10-5 | 2,59 x 10-5 | 1,014 | 0,0337 | 3,76 x 10-5 | 0.689 |
| 450 | 0,783 | 2,48 x 10-5 | 2,89 x 10-5 | 1,021 | 0,0371 | 4,22 x 10-5 | 0.683 |
| 500 | 0,705 | 2,67 x 10-5 | 3,69 x 10-5 | 1,030 | 0,0404 | 5,57 x 10-5 | 0,680 |
| 550 | 0.642 | 2,85 x 10-5 | 4,43 x 10-5 | 1,039 | 0,0436 | 6,53 x 10-5 | 0,680 |
| 600 | 0,588 | 3,02 × 10-5 | 5,13 × 10-5 | 1,055 | 0,0466 | 7,51 x 10-5 | 0,680 |
| 650 | 0.543 | 3,18 x 10-5 | 5,85 x 10-5 | 1,063 | 0,0495 | 8,58 x 10-5 | 0.682 |
| 700 | 0,503 | 3,33 x 10-5 | 6,63 x 10-5 | 1,075 | 0,0523 | 9,67 × 10-5 | 0.684 |
| 750 | 0,471 | 3,48 x 10-5 | 7,39 x 10-5 | 1,086 | 0,0551 | 10,8 x 10-5 | 0.686 |
| 800 | 0,441 | 3,63 x 10-5 | 8,23 x 10-5 | 1,098 | 0,0578 | 12,0 × 10-5 | 0.689 |
| 850 | 0,415 | 3,77 x 10-5 | 9,07 x 10-5 | 1 110 | 0,0603 | 13,1 x 10-5 | 0,692 |
| 900 | 0,392 | 3,90 x 10-5 | 9,93 x 10-5 | 1,121 | 0,0628 | 14,3 x 10-5 | 0.696 |
| 950 | 0,372 | 4,02 x 10-5 | 10,8 x 10-5 | 1,132 | 0,0653 | 15,5 x 10-5 | 0.699 |
| 1000 | 0,352 | 4,15 x 10-5 | 11,8 x 10-5 | 1,142 | 0,0675 | 16,8 x 10-5 | 0,702 |
| 1100 | 0,320 | 4,40 x 10-5 | 13,7 x 10-5 | 1,161 | 0,0723 | 19,5 x 10-5 | 0,706 |
| 1200 | 0,295 | 4,63 x 10-5 | 15,7 x 10-5 | 1,179 | 0,0763 | 22,0 × 10-5 | 0,714 |
| 1300 | 0,271 | 4,85 x 10-5 | 17,9 x 10-5 | 1,197 | 0,0803 | 24,8 x 10-5 | 0,722 |
Zależność między temperaturą a przewodnością cieplną powietrza, obowiązująca dla temperatury od 100 K do 1600 K, jest następująca:
lub:
- : temperatura wyrażona w K.
- : przewodnictwo cieplne w W m −1 K −1
Zależność między lepkością dynamiczną powietrza a temperaturą jest następująca:
lub:
- : temperatura w K.
- : lepkość dynamiczna w kg m −1 s −1
Zależność między lepkością kinematyczną powietrza a temperaturą jest następująca:
lub:
- : temperatura w K.
- : lepkość kinematyczna wm 2 / s
Zgodnie z informacją WPI (en) , zależność między ciepłem właściwym powietrza a temperaturą jest następująca:
lub:
- : temperatura w K.
- : ciepło właściwe w J kg −1 K −1
Nacisk
Ze względu na spadek ciśnienia powietrza wraz z wysokością konieczne jest zwiększenie ciśnienia w kabinach samolotów i innych statków powietrznych . W praktyce ciśnienie wywierane w kabinach jest większe niż ciśnienie zewnętrzne, chociaż mniejsze niż ciśnienie na poziomie gruntu.
Sprężone powietrze jest również stosowany w nurkowania .
Skraplanie
Powietrze składa się z różnych gazów, które po dostatecznym ochłodzeniu ostatecznie przechodzą w stan ciekły, a następnie w stan stały . Na przykład tlen zestala się w temperaturze -218 ° C , z azotu upłynnia się w -195 ° C . W temperaturze -270 ° C (około 3 K ) wszystkie gazy z wyjątkiem helu są wówczas w stanie stałym i uzyskuje się „zamarznięte powietrze”.
Powietrze nie mogło zostać skroplone przed poznaniem krytycznych ciśnień i temperatur, które wyznaczają teoretyczne granice, powyżej których związek może istnieć tylko w stanie gazowym. Ponieważ powietrze jest mieszaniną, wartości te nie mają ścisłego znaczenia, ale w rzeczywistości w temperaturze powyżej -140 ° C powietrze nie jest już skraplane.
Temperatura wrzenia składników powietrza
| Nazwisko | Formuła | Temperatura |
|---|---|---|
| Azot | Nr 2 | -195,79 ° C , ciekły azot |
| Ditlen | O 2 | −183 ° C , ciekły tlen |
| Argon | Ar | -185,85 ° C |
| Dwutlenek węgla | CO 2 | -56,6 ° C przy 5,12 atm |
| Neon | Urodzony | -246,053 ° C |
| Hel | Hej | -268,93 ° C , ciekły hel |
| Podtlenek azotu | NIE | -151,8 ° C |
| Krypton | Kr | -154,34 ° C |
| Metan | CH 4 | -161,52 ° C |
| Diwodór | H 2 | -252,76 ° C , ciekły wodór |
| Podtlenek azotu | N 2 O | -88,5 ° C |
| Ksenon | Xe | -108,09 ° C |
| Dwutlenek azotu | NIE 2 | 21,2 ° C |
| Ozon | O 3 | -111,9 ° C |
| Radon | Rn | -61,7 ° C |
Pierwsze krople ciekłego powietrza zostały uzyskane prawie jednocześnie przez Louisa Paula Cailleteta i Raoula-Pierre Picteta w 1877 roku , przez nagłą ekspansję między 300 a 1 atmosferą.
W 1894 roku holenderski fizyk Heike Kamerlingh Onnes opracował pierwszą instalację ciekłego powietrza. W ciągu następnych 40 lat naukowcy z Francji, Wielkiej Brytanii, Niemiec i Rosji wprowadzili wiele ulepszeń do tego procesu.
Sir James Dewar po raz pierwszy skroplił wodór w 1898 r., A hel Heike Kamerlingh Onnes , najtrudniejszy gaz do skroplenia, w 1908 r .
Niezależnie od Carl von Linde , Georges Claude opracowany w 1902 roku to proces przemysłowy do skraplania powietrza.
Symboliczny
- W dziedzinie nienaukowej powietrze jest jednym z czterech elementów (obok ognia , wody i ziemi ), które kiedyś uważano (i nadal uważano w niektórych kulturach) za substancje, na których opiera się całe życie. On jest symbolem Ducha.
- Powietrze jest również często kojarzone z różnymi innymi koncepcjami, takimi jak rodzina mieczy w talii tarota .
Uwagi i odniesienia
Uwagi
- To jest masa molowa suchego powietrza.
Bibliografia
- „ Air ” , na olivier.fournet.free.fr (dostęp: 4 marca 2010 )
- (en) Compressed Gas Association, Podręcznik sprężonych gazów , Springer,1999, 4 th ed. , 702 pkt. ( ISBN 0-412-78230-8 , czytaj online ) , str. 234
- (en) Robert H. Perry i Donald W. Green , Perry's Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , str. 2-50
- (w) Philip E. Ciddor, „ Współczynnik załamania światła powietrza: nowe równania dla widzialnej i bliskiej podczerwieni ” , Applied Optics , Vol. 35 N O 9,1996, s. 1566-1573 ( DOI 10.1364 / AO.35.001566 )
- (in) Recent Global CO2 na noaa.gov, dostęp 21 kwietnia 2021 r.
- (w) The Keeling Curve , strona internetowa keelingcurve.ucsd.edu, dostęp 23 kwietnia 2015
- Stężenie CO 2 w atmosferze ziemskiej
- Stężenie CO 2 zmierzone w Mauna Loa (Hawaje), NOAA.
- Stężenie metanu mierzone w Mauna Loa (Hawaje), NOAA.
- W praktyce mocno wysuszone powietrze nadal zawiera śladowe ilości pary wodnej.
- Źródło danych: Dwutlenek węgla: (en) NASA - Earth Fact Sheet , styczeń 2007. Metan: IPCC TAR; tabela 6.1, 1998 (en) Trzeci raport oceniający IPCC „Zmiany klimatu 2001” GRID-Arendal w 2003 r. Łączna wartość NASA wyniosła 17 ppmv na 100%, a CO 2wzrosła tutaj o 15 ppmv . Aby znormalizować, N 2 należy zmniejszyć o 25 ppmv, a O 2 o 7 ppmv .
- „ Air refractive index ” , na olivier.fournet.free.fr (dostęp: 4 marca 2010 )
- Specjaliści od chemii
- Chemical Professionals , nie znaleziono 11 sierpnia 2013
- Ten dokument ze strony internetowej WPI na stronie wpi.edu
Zobacz też
Powiązane artykuły
- Gęstość powietrza
- Masa powietrza
- Psychrometria
- Wilgotne powietrze
- Zanieczyszczenie powietrza i artykuły z kategorii: Zanieczyszczenie powietrza
- Jakość powietrza