Reakcja Nagaty
Reakcji Nagata jest reakcja organiczny opisany Wataru Nagata (de) , który składa się z hydrocyjanowania w a, p-nienasyconych związków karbonylowych .
Reakcja obejmuje cyjanodietyloglin (CH 3 CH 2 ) 2 AlCNlub odczynnik Nagaty, który można wytworzyć w reakcji trietyloglinu Al 2 (CH 2 CH 3 ) 6z cyjanowodorem HCN. Odczynnik ten sprawia, że możliwe jest wprowadzenie do nitrylową grupę na alfa, beta-nienasyconego związku karbonylowego (R 1 i R 2 poniżej oznaczają H atom lub grupę alkilową lub arylową ), po dodaniu do z kwasem w obojętnym rozpuszczalniku, takim jak ' etyl eter , tetrahydrofuran (THF) lub benzen .
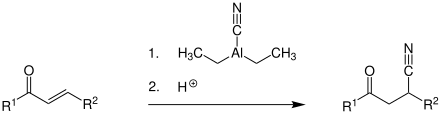
Poniżej podsumowano mechanizm reakcji . Α, β-nienasycony związek karbonylowy ( 1 ) zaczyna się od ataku cyjanodimetyloglinu ( 2 ). Wiązanie zawarty między aluminiową atomu i tlenu, atomu w karbonylowego podwójne wiązanie, które jest otwarte, natomiast a, b przenosi podwójne wiązanie z atomem tlenu, oraz wiąże grupy nitrylowej do węglu beta ( 3 ). Wiązanie podwójne jest otwierany przez protonowanie , uzyskując produkt 4 zwalniając jon dietyloglinu (CH 3 CH 2 ) 2 Al+ .

Reakcja Nagata służy do łączenia grup nitrylowych ze związkami organicznymi , na przykład do produkcji biocząsteczek . Zatem β-amino α-hydroksykwasy mogą być wytwarzane przez następującą hydrolizę związków przygotowanych z odczynnikiem Nagata, co z kolei umożliwia produkcję antybiotyków β-laktamowych .
Uwagi i odniesienia
- (de) W. Nagata, M. Yoshioka i S. Hirai , „ Eine neue hydrocyanierungs-method ” , Tetrahedron Letters , tom. 3, n O 11 1962, s. 461-466 ( DOI 10.1016 / S0040-4039 (00) 70493-X , czytaj online )
- (po) Zerong Wang , " Nagata reakcji " , Comprehensive Organie Nazwa reakcje i odczynniki , 2010, s. 2007-2010 ( ISBN 978-0-470-63885-9 , DOI 10.1002 / 9780470638859.conrr451 , czytaj online )
- (w) Wataru Mitsuru Nagata i Yoshioka , „ Cyjanki alkiloglinu mają silne odczynniki do hydrocyjanacji ” , Tetrahedron Letters , Vol. 7, n O 18 1966, s. 1913-1918 ( DOI 10.1016 / S0040-4039 (00) 76271-X , czytaj online )
- (w) José Andrés, María A. Martínez, Rafael Alfonso Pedrosa i Pérez-Encabo , „ Stereoselective cyjanation of chiral α-aminoaldehydes by reaction with Nagata's reagent: the way to enancjopure β-amino-α-hydroxy acid ” , Tetrahedron : Asymetria , obj. 12 N O 2 19 lutego 2001, s. 347-353 ( DOI 10.1016 / S0957-4166 (01) 00044-1 , Tetrahedron: Asymmetry)