Reakcja Duffa
Reakcji Duff lub aromatyczny formylowanie urotropiny jest formylowanie reakcji stosowane w chemii organicznej dla syntezy benzaldehydu z heksaminy (methenamine) jako źródło węgla, formyl . Ta reakcja jest formalnie oparta na aromatycznej substytucji elektrofilowej, w której formą elektrofilową jest jon iminiowy CH 2 + NR 2 . Początkowa reakcja wytwarza pochodną iminiową , która jest następnie hydrolizowana do aldehydu . Ta reakcja wymaga silnej grupy donora elektronów w jądrze aromatycznym, takiej jak grupa fenolowa . Ta reakcja umożliwia na przykład syntezę 3,5-di-tert-butylosalicylaldehydu:
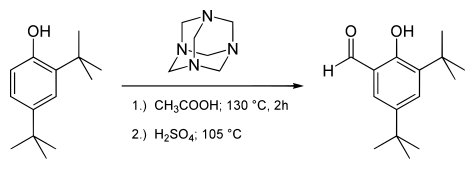
lub aldehyd syringenowy :

Mechanizm reakcji

Mechanizm reakcji opisano powyżej. Heksamina jest początkowo zakwaszana (reakcja ze słabym kwasem, tutaj kwasem octowym ) i kończy się przegrupowaniem do jonu iminiowego z grupą metinową . Ta silnie elektrofilowa grupa doda się w pozycji orto grupy fenolowej, która traci proton w wyniku reakcji kwasowo-zasadowej z uprzednio utworzonym octanem i przekształca się w grupę ketonową. Nowo powstały związek jest przekształcany w benzyloaminową pochodną fenolu na drodze równowagi keto-enolowej (forma fenolowo - aromatyczna - jest znacznie stabilniejsza niż forma cykloheksa-2,4-dienonu).
Grupa pseudoheksaminowa związana z fenolem jest ponownie zakwaszana kwasem octowym i ponownie przechodzi w jon iminiowy, tak że to atomy węgla i azotu w pozycji benzylowej pełnią tę funkcję. Ten ostatni związek pośredni jest następnie hydrolizowany, tworząc końcową pochodną benzaldehydu, tutaj salicylaldehyd (lub 2-hydroksybenzaldehyd).
Uwagi i odniesienia
- (w) JC Duff i EJ Bills , „ Reakcje z heksametylenotetraminą i związkami fenolowymi. Część I. Nowa metoda otrzymywania kwasów 3- i 5-aldehydosalicylowych ” , J. Chem. Soc. ,1932, s. 1987-1988 ( ISSN 0368-1769 , DOI 10.1039 / JR9320001987 ).
- (w) JC Duff i EJ Bills , „ Reakcje z heksametylenotetraminą i związkami fenolowymi. Część druga. Tworzenie aldehydów fenolowych. Distinctive Behavior of p-nitrophenol ” , J. Chem. Soc. ,1934, s. 1305-1308 ( ISSN 0368-1769 , DOI 10.1039 / JR9340001305 ).
- (in) JC Duff , „ Nowa ogólna metoda otrzymywania o-hydroksyaldehydów z fenoli i heksametylenotetraminy ” , J. Chem. Soc. ,1941, s. 547-550 ( ISSN 0368-1769 , DOI 10.1039 / JR9410000547 ).
- (in) JC Duff , „ Nowa metoda przygotowania p-dialkiloaminobenzaldehydów ” , J. Chem. Soc. ,1945, s. 276-277 ( ISSN 0368-1769 , DOI 10.1039 / JR9450000276 ).
- (w) LN Ferguson , „ The Synthesis of Aromatic Aldehydes ” , Chem. Obrót silnika. , vol. 38 N O 21946, s. 227–254 ( ISSN 0009-2665 , PMID 21024865 , DOI 10.1021 / cr60120a002 ).
- (en) Y. Ogata , A. Kawasaki i wsp. , „ Kinetyka i mechanizm reakcji Duffa ” , Tetrahedron , tom. 24 N O 141968, s. 5001–5010 ( ISSN 0040-4020 , DOI 10.1016 / S0040-4020 (01) 88408-8 ).
- (en) JF Larrow i EN Jacobsen , " (R, R) -N, N'-Bis (3,5-di-tert-butylosalicylideno) -1,2-cykloheksanodiaminomangan (III) Chlorek, A wysoce enancjoselektywne epoksydowanie Catalyst ” , Org. Synth. , vol. 75,1998, s. 1 ( ISSN 0078-6209 , DOI 10.15227 / orgsyn.075.0001 ).
- (in) CFH Allen i GW Leubner , „ aldehyd syringic ” , Org. Synth. , vol. 31,1951, s. 92 ( ISSN 0078-6209 , DOI 10.15227 / orgsyn.031.0092 ).
- (w) MB Smith and J. March , March's advanced organic chemistry: Reactions, Mechanisms and Structure , Hoboken (NJ), John Wiley & Sons ,2013, 7 th ed. , 2080 s. ( ISBN 978-0-470-46259-1 , prezentacja online ) , rozdz. 11 („Substytucja aromatyczna, elektrofilowa”) , str. 628.