Reakcja Blaise'a
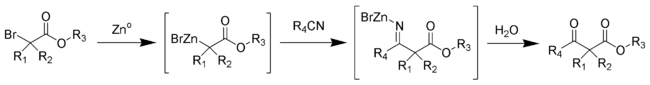
Reakcji Blaise jest organiczny sprzęgania reakcja , która umożliwia, aby utworzyć p- ketoestru z metalicznym cynkiem , a alfa -bromoester i nitrylu . Reakcja została po raz pierwszy opublikowana przez Edmonda Blaise'a w 1901 roku.
Prezentacja syntetyczna
Podczas tej syntezy powstaje pośrednia metaloimina, która następnie ulega hydrolizie, dając pożądany β- ketoester.
Estry alifatyczne z zawadą przestrzenną generalnie dają wyższe wydajności.
W tej reakcji tolerowane są wolne grupy hydroksylowe, co jest rzadkością w reakcjach z udziałem związków metaloorganicznych pochodzących z halogenków.
Szczegółowy mechanizm
Mechanizm reakcji Blaise'a polega na tworzeniu kompleksu cynkoorganicznego z bromem w α karbonylu estru. To sprawia, że węgiel w α jest nukleofilowy, umożliwiając elektrofilowy atak węgla nitrylu. Wtedy ujemnie naładowany azot nitrylu oddziałuje z kationowym monobromkiem cynku. Β- enaminoester (tautomer pośredniej iminy w powyższym schemacie) wydziela się podczas obróbki środowiska reakcji z 50% wodnym roztworem K 2 CO 3 . Jeśli β- ketoester jest pożądanym produktem, dodatek molowego kwasu chlorowodorowego umożliwia hydrolizę β- enaminoestru do β- ketoestru.

Uwagi i odniesienia
(fr) Ten artykuł jest częściowo lub w całości zaczerpnięty z artykułu z Wikipedii w języku angielskim zatytułowanego „ Blaise reaction ” ( patrz lista autorów ) .- Blaise, C. r. , 1901.
- Rinehart, Org. Syn. , 1963.
- Rao, Czworościan , 2008.
- Cason, J. Org. Chem. 1953.
- Hannick, J. Org. Chem. 1983.
- Wang, Synlett , 2005
Zobacz też
Bibliografia
- Edmond Blaise, „ Nowe reakcje pochodnych metaloorganicznych (II): etery α- alkilo -β- ketonowe ”, Cotygodniowe sprawozdania z sesji Akademii Nauk , t. 132,Styczeń-czerwiec 1901, s. 478 ( czytaj online ).
- (en) Kenneth L. Rinehart, Jr., » sec- Butyl a- n -Caproylpropionate [Octanoic Acid, 2-methyl-3-Oxo, sec -butyl Ester] ” , Organic Syntheses , al. lot. 4, 1963, s. 120 ; lot. 35, 1955, s. 15 ( czytaj online , sprawdzono 29 czerwca 2018 ).
- (en) H. Surya Prakash Rao, Shaik Rafi i K. Padmavathy, „ The Blaise Reaction ” , Tetrahedron , vol. 64,2008, s. 8037-8043.
- (en) James Cason, Kenneth L. Rinehart, Jr. and Stephen D. Thornton, Jr., „ The Preparation of β- Keto Esters from Nitriles and α -Bromoesters ” , Journal of Organic Chemistry , vol. 18,1953, s. 1594 ( DOI 10.1021 / jo50017a022 ).
- (en) Steven M. Hannick i Yoshito Kishi, „ An Improved Procedure for the Blaise Reaction: A Short, Practical Route to the Key Intermediates of the Saxitoxin Synthesis ” , J. Org. Chem. , vol. 48,1983, s. 3833 ( DOI 10.1021 / jo00169a053 ).
- (en) Jiří Pospíšil i István E. Markó, » Total Synthesis of Jerangolid D « , Journal of the American Chemical Society , ASAP,2007( DOI 10.1021 / ja0691728 ).
- (en) Fang-Dao Wang i Jian-Min Yue, „ Total Synthesis of ( R ) - (+) - Kavain via (MeCN) 2PdCl2-Catalyzed Isomeryization of a cis Double Bond and Sonochemical Blaise Reaction ” , Synlett , tom. 13,Sierpień 2005, s. 2077-2079 ( DOI 10.1055 / s-2005-871953 ).
Powiązany artykuł
Link zewnętrzny
- „Blaise Réaction” na portalu Organic Chemistry rozwija temat i zawiera bibliografię ostatnich publikacji.