Reakcja Kulinkovicha-Szymoniaka
Kulinkovich-Szymoniak reakcji stanowi cyklopropanowanie reakcji nitryli, co prowadzi do cyclopropylamines pierwotnych.

Odkrycie
Reakcja Kulinkovich-Szymoniak została po raz pierwszy opisana w 2001 roku przez Bertusa i Szymoniaka. To przedłużenie reakcji Kulinkowicza . Jest to związane z reakcją Kulinkovicha-de Meijere'a, która również prowadzi do powstania aminocyklopropanów, ale nie pozwala na bezpośredni dostęp do pierwszorzędowych cyklopropyloamin. Dlatego te dwie transformacje można uznać za komplementarne.
Mechanizm
Podobnie jak w przypadku reakcji Kulinkovicha, mechanizm reakcji Kulinkovicha-Szymoniaka polega najpierw na tworzeniu się tytanacyklopropanu 1 . Ten ostatni następnie podlega insercji 1,2 grupy nitrylowej, prowadząc do azatytanacyklopentenu 2 . Ten kompleks jest ogólnie dość stabilny. Najczęściej dodatek kwasu Lewisa, takiego jak eterat trifluoroboranu, jest konieczny do wywołania skurczu pierścienia prowadzącego do pożądanego aminocyklopropanu 3 po hydrolizie .
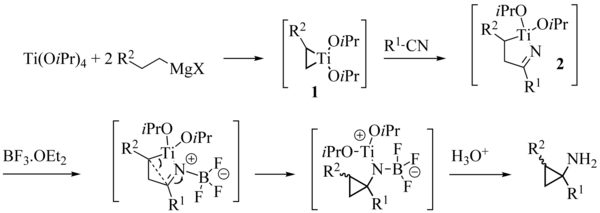
Specjalny przypadek nitryli zawierających heteroatom α
W niektórych przypadkach dobre wydajności można uzyskać bez konieczności dodawania kwasu Lewisa, w szczególności z nitryli zawierających heteroatom w pozycji a . Zjawisko to można wyjaśnić wywołując chelatację związku pośredniego 4 przez atom magnezu lub tytanu, zapewniającą wystarczającą aktywację, aby umożliwić zamknięcie cyklopropanu.

Przypadek cyjanoestrów
Funkcja nitrylowa jest znacznie bardziej reaktywna niż funkcja estrowa w stosunku do tytanacyklopropanów. W warunkach reakcji Kulinkovicha-Szymoniaka cyjanoestry są zatem najpierw atakowane przez związki metaloorganiczne na grupę nitrylową. Gdy funkcja estrowa znajduje się w odpowiedniej odległości, zachodzi cyklizacja prowadząca do spiro - laktamu (4). W tym przypadku, ilość katalityczna tetra izo propyloxytitane na tyle, aby uzyskać dobrą wydajność. Cyjanowęglany reagują analogicznie do cyjanoestrów.

Wewnątrzcząsteczkowe reakcje Kulinkovicha-Szymoniaka
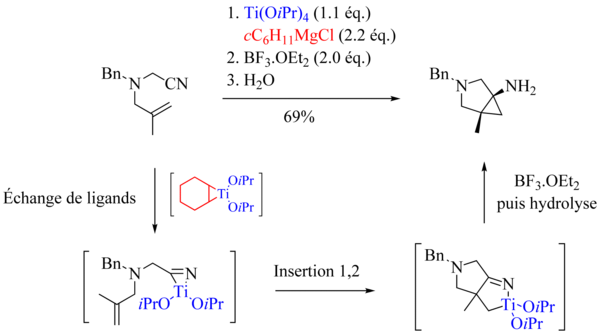
W odróżnieniu od reakcji Kulinkovicha i Kulinkovicha-de Meijere'a nie ma obecnie ogólnej metody przeprowadzania reakcji Kulinkovicha-Szymoniaka z wymianą ligandów, czyli sprzęganiem nitrylu i olefiny. Najprawdopodobniej można to wytłumaczyć bardzo wysoką reaktywnością nitryli w stosunku do tytanacyklopropanów. Niemniej jednak, w szczególnym przypadku reakcji wewnątrzcząsteczkowych, zespołowi Bertusa i Szymoniaka udało się opracować metodę skutecznie prowadzącą do spodziewanych bicyklicznych aminocyklopropanów. Konieczne jest stosowanie halogenku cykloheksylomagnezu.
Powiązane reakcje
Reakcja Kulinkovicha-Szymoniaka związana jest z innymi przemianami:
- ; reakcja Kulinkovicha prowadząca do cyklopropanoli z estrów karboksylowych.
- Kulinkovich-de Meijere reakcji , co prowadzi do aminocyclopropanes z amidów.
Źródła dalszych informacji
Istnieje artykuł przeglądowy poświęcony tej reakcji:
- P. Bertus, J. Szymoniak, Synlett , 2007 , 1346–1356.
Można również odnieść się do następującego artykułu, w którym opisano metody syntezy aminocyklopropanów przy użyciu chemii tytanu:
- A. de Meijere, SI Kozhushkov, AI Savchenko, J. Organomet. Chem. , 2004 , 689 , 2033–2055.
Reakcja Kulinkovicha-Szymoniaka jest również omawiana w niedawnym felietonowym artykule:
- A. Wolan i Y. Six, Tetrahedron , 2010 , 66 , 15–61.
Uwagi i odniesienia
- P. Bertus i J. Szymoniak , „ Nowa i łatwa droga do pierwszorzędowych cyklopropyloamin z nitryli ”, Chem. Wspólny. ,2001, s. 1792-1793 ( DOI 10.1039 / b105293b )
- V. Chaplinski, A. de Meijere, Angew. Chem. Int. Ed. Engl. , 1996 , 35 , 413-414.
- P. Bertus, J. Szymoniak, J. Org. Chem. , 2002 , 67 , 3965-3968.
- P. Bertus, J. Szymoniak, Synlett , 2003 , 265-267.
- F. Cadoret, Y. Six, Tetrahedron Lett. , 2007 , 48 , 5491-5495.
- C. Laroche, D. Harakat, P. Bertus, J. Szymoniak, Org. Biomol. Chem. , 2005 , 3 , 3482-3487.
- C. Laroche, P. Bertus, J. Szymoniak, Tetrahedron Lett. , 2003 , 44 , 2485-2487.