Reakcja Bucherera-Bergsa
Reakcji Bucherera-Bergowie jest organicznym reakcji chemicznej między związkiem karbonylowym ( aldehyd lub keton ) lub cyjanohydryny , węglanem amonu i cyjankiem potasu , tworząc hydantoiny :

Nie należy go mylić z reakcją Bucherera (lub reakcją Bucherera-Lepetita), która przekształca naftol w naftyloaminę , a te dwie reakcje nazwano na cześć ich odkrywcy, niemieckiego chemika Hansa Theodora Bucherera .
Historyczny
Reakcje podobne do reakcji Bucherera-Bergsa po raz pierwszy zaobserwowali w 1905 i 1914 roku Ciamician i Silber, którzy otrzymali 5,5-dimetylohydantoinę z mieszaniny acetonu i cyjanowodoru wystawionej na działanie słońca przez pięć do siedmiu miesięcy. W 1929 roku Bergs złożył patent opisujący syntezę wielu 5-podstawionych hydantoin . Bucherer udoskonalił metodę Bergsa, odkrywając, że możliwe jest stosowanie niższych temperatur i ciśnień. Bucherer i Steiner odkryli również, że cyjanohydryny reagują tak samo jak związki karbonylowe, tworząc hydantoiny. Później Bucherer i Lieb odkryli, że 50% alkohol był skutecznym rozpuszczalnikiem dla reakcji, aldehydy dobrze reagowały, a ketony dały doskonałe wydajności. W 1934 roku Bucherer i Steiner zaproponowali mechanizm reakcji, który choć stwarzał pewne problemy, był dość precyzyjny.
Mechanizm reakcji
Dodanie KCN do związku karbonylowego daje cyjanohydrynę . Mechanizm jest kontynuowany od S N 2 do NH 3, tworząc aminonitryl . Reakcje addycji nukleofilowej z aminonitrylu do CO 2 tworzy cyjano-karbaminowego, który przez wewnątrzcząsteczkowe cyklizują reakcji do 5-imino-oksazolidyn-2-onu. Następnie 5-imino-oksazolidyn-2-on przegrupowuje się w hydantoinę poprzez izomer izocyjanianowy .
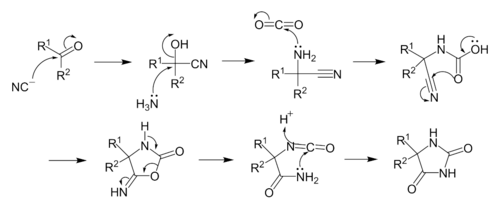
Poprawa
W przeszłości reakcja Bucherera-Bergsa wiązała się z problemami z polimeryzacją, długimi czasami reakcji i trudną obróbką. Ewentualną poprawą reakcji Bucherera-Bergsa jest zastosowanie ultradźwięków , umożliwiających m.in.przyspieszenie reakcji . W ten sposób przygotowano 5,5-dipodstawione hydantoiny w reakcji Bucherera-Bergsa pod ultradźwiękami. W porównaniu z literaturą, użycie ultradźwięków obniża temperaturę reakcji, skraca czas reakcji, poprawia wydajność i upraszcza obróbkę.
Wariacje
Stosowanie 2-metylenoazyrydyny
Jedną z ograniczeń reakcji Bucherera-Bergsa jest brak różnorodności w powstałych produktach, ponieważ jedyną możliwą zmianą jest struktura początkowego związku karbonylowego.
Jedną z możliwości zwiększenia tej różnorodności jest połączenie reakcji z 2-metylenazyrydyną i reakcją Bucherera-Bergsa w syntezie w jednym naczyniu :

Początkowo, 2-methyleneaziridine ( 1 ) poddaje się reakcji z odczynnikiem Grignarda , a fluorowcowany R pochodnej 2 -X, w reakcji katalizowanej przez Cu (I), w wyniku czego pierścień 2-methyleneaziridine do otwartego i powstawaniem ketoiminy ( 2 ). Ketiminę umieszcza się w obecności odczynników Bucherera-Bergsa, tworząc 5,5'-dipodstawioną hydantoinę ( 3 ). Ta reakcja ma trzy punkty różnorodności chemicznej, strukturę początkowej azyrydyny , odczynnika Grignarda i pochodnej chlorowcowanej, które można zmienić, umożliwiając syntezę różnych hydantoin.
Synteza ditiohydantoin
Odmianą reakcji Bucherera-Bergsa jest traktowanie związku karbonylowego dwusiarczkiem węgla i cyjnaurem amonowym w metanolu w celu wytworzenia siarkowego równoważnika hydantoiny, 2,4-ditiohydantoiny:
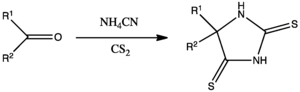
Podobnie reakcja pomiędzy ketonem , monotiokarbaminianem amonu i cyjankiem sodu umożliwia otrzymanie 5,5-dipodstawionej 4-tiohydantoiny.
Aplikacje
Hydantoiny powstałe w reakcji Bucherera-Bergsa mogą mieć kilka zastosowań:
- są przydatne w chemii węglowodanów;
- są ważnymi związkami heterocyklicznymi o działaniu biologicznym i są stosowane w szczególności jako związki farmaceutyczne (np. 5,5-difenylohydantoina, znana jako dilantyna )
- są prekursorami sztucznych aminokwasów .
Uwagi i odniesienia
- (De) HT Bucherer i H. Fischbeck , „ Heksahydrodifenyloamina i jej pochodne ” , Journal für praktische Chemie , vol. 140, n os 3/41934, s. 69-89 ( ISSN 0941-1216 ).
- (de) HT Bucherer i W. Steiner , „ O reakcjach α-oksy-nitryli i α-aminonitryli - Synthesis of hydantoins ” , Journal für praktische Chemie , vol. 140, n kość 10/12,1934, s. 291-316 ( ISSN 0941-1216 ).
- Bergs, H. Ger. poklepać. 566, 094 (1929).
- (en) E. Ware , „ The Chemistry of the Hydantoins ” , Chem. Obrót silnika. , vol. 46, n o 3,1950, s. 403-470 ( ISSN 0009-2665 , DOI 10.1021 / cr60145a001 ).
- (en) J. Li , L. Li i in. , „ Wydajna i wygodna procedura syntezy 5,5-dipodstawionych hydantoin pod ultradźwiękami ” , Ultrasonics Sonochemistry , vol. 3, N O 2Lipiec 1996, S141-S143 ( ISSN 1350-4177 , DOI 10.1016 / 1350-1477 (96) 00011-2 ).
- (en) C. Mountain , JJ Shiers i wsp. , „ Szybkie generowanie złożoności molekularnej przy użyciu„ sekwencyjnych ”reakcji wieloskładnikowych: synteza w jednym naczyniu 5,5′-dipodstawionych hydantoin z metylenoazyrydyny ” , Tetrahedron Lett. , vol. 47 N O 52,grudzień 2006, s. 9207-9209 ( ISSN 0040-4039 , DOI 10.1016 / j.tetlet.2006.10.135 ).
- (w) HC Carrington , „ Tiohydantoiny. Część I. Przygotowanie 5: 5-dipodstawionych 2: 4-ditiohydantoin z odpowiednich ketonów ” , Journal of the Chemical Society ,1947, s. 681-683 ( ISSN 0368-1769 , DOI 10.1039 / JR9470000681 ).
- (en) HC Carrington , CH Vasey i wsp. , „ Tiohydantoiny. Część V. Nowa synteza 5: 5-dipodstawionych4-tiohydantoin ” , Journal of the Chemical Society ,1959, s. 396-397 ( ISSN 0368-1769 , DOI 10.1039 / JR9590000396 ).
- (fr) Ten artykuł jest częściowo lub w całości zaczerpnięty z artykułu z angielskiej Wikipedii zatytułowanego „ Reakcja Bucherera-Bergsa ” ( zobacz listę autorów ) .