Jodometan
| Jodometan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Struktura jodometanu |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nazwa IUPAC | jodek metylu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonimy |
Monojodometan metylu |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O ECHA | 100,000,745 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O WE | 200-819-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| UŚMIECHY |
CI , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / CH3I / c1-2 / h1H3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | bezbarwna ciecz o charakterystycznym zapachu. brązowieje pod wpływem światła i wilgoci. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości chemiczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formula |
C H 3 I [Izomery] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa cząsteczkowa | 141,939 ± 0,001 g / mol C 8,46%, H 2,13%, I 89,41%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moment dwubiegunowy | 1,59 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości fizyczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fuzja | -66,5 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * Temperatura wrzenia | 42,5 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rozpuszczalność | w wodzie o temperaturze 20 ° C : 14 g · l -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametr rozpuszczalności δ | 9,9 cal 1/2 · cm -3/2 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa objętościowa | 2,3 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura samozapłonu | 352 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Granice wybuchowości w powietrzu | 8,5 - 66% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nasycenie prężności par | przy 20 ° C : 50 kPa , 24,09 psi w 55 ° C |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punkt krytyczny | 65,9 bara , 254,85 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochemia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
równanie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości elektroniczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 energia re jonizacji | 9,538 eV (gaz) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości optyczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Współczynnik załamania światła | 1,5304 ( 20 ° C , D) 1,5293 ( 21 ° C , D) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Środki ostrożności | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Niebezpieczeństwo H301, H312, H315, H331, H335, H351, H301 : Działa toksycznie po połknięciu H312 : Działa szkodliwie w kontakcie ze skórą H315 : Działa drażniąco na skórę H331 : Działa toksycznie w następstwie wdychania H335 : Może podrażniać drogi oddechowe H351 : Podejrzewa się, że powoduje raka (wskazać drogę narażenia, jeżeli formalnie udowodniono, że nie ma innej drogi narażenia prowadzi do tego samego zagrożenia) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Produkt niesklasyfikowanyKlasyfikacja tego produktu nie została jeszcze zatwierdzona przez Toxicological Directory Service Disclosure na poziomie 0,1% zgodnie z wykazem ujawnień składników |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2644 : JODEK METYLU |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klasyfikacja IARC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa 3 : Nie podlega klasyfikacji ze względu na jego rakotwórczość dla ludzi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekotoksykologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 1,51-1,69 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jednostki SI i STP, chyba że określono inaczej. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Jodometan , znany również jako jodek metylu jest związek chemiczny o wzorze CH 3 I, czasami zaznaczane MeI. Jest to haloalkan , wywodzący się z metanu , w którym jeden z atomów wodoru został zastąpiony atomem jodu . Ma postać bezbarwnej, gęstej, lotnej cieczy o eterycznym zapachu, która dzięki obecności diody I 2 przybiera fioletowawą cerę pod wpływem światła .. Jodometan jest powszechnie stosowany w syntezie organicznej jako donor grup metylowych , w reakcjach zwanych metylacjami . Jest naturalnie emitowany w małych ilościach przez ryż .
Jodometan hydrolizuje w temperaturze 270 ° C , tworząc jodowodór , tlenek węgla i dwutlenek węgla .
Używa
Reakcje metylacji
Jodometan jest używany głównie do metylacji innych związków w reakcjach typu S N 2 . Łatwo może zostać zaatakowany sterycznie przez nukleofile, a jodek jest dobrą bronią nuklearną .
Można go np. Stosować do metylacji kwasów karboksylowych (przemiana do metanonianu karboksylu ) lub fenoli (tworzenie metoksybenzenów):

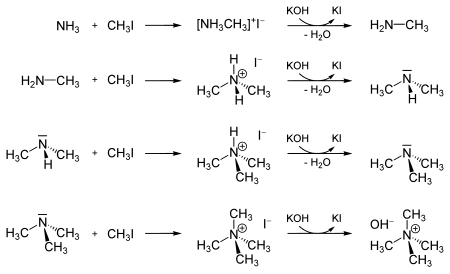
Może być również stosowany do metylacji amoniaku i pochodnych amin do jodoamonu. Ta reakcja może trwać aż do powstania wodorotlenku tetrametyloamoniowego.
Jodometan jest również prekursorem jodku metylomagnezu lub „MeMgI”, odczynnika Grignarda często używanego w syntezie organicznej . MeMgI tworzy się dość łatwo, dlatego często jest używany jako przykład w nauczaniu przygotowywania tych odczynników. Stosowanie MeMgI zostało jednak wyparte przez zastosowanie metylolitu .
W procesie Monsanto MeI powstaje in situ w reakcji metanolu i jodowodoru . Następnie reaguje z tlenkiem węgla w obecności rodu, tworząc jodek etanoilu , prekursor kwasu octowego (otrzymanego w wyniku hydrolizy ). Spora część kwasu octowego produkowanego na świecie jest wytwarzana tą metodą.
Inny
Oprócz zastosowania jako środka metylującego, niektórzy proponują użycie jodometanu jako fungicydu , herbicydu , insektycydu , nematocydu lub nawet w gaśnicach . Może być stosowany jako środek odkażający glebę, zastępując bromometan (którego użycie zostało zakazane przez Protokół Montrealski ) oraz w mikroskopii ze względu na jego właściwości związane ze współczynnikiem załamania światła.
Produkcja i synteza
Jodometan można syntetyzować na drodze egzotermicznej reakcji jodu z metanolem w obecności fosforu . Diidoda jest następnie przekształcana in situ w trójjodek fosforu . Wynika z nukleofilowej substytucji metanolem:
Inną metodą jest reakcja siarczanu dimetylu z jodkiem potasu w obecności węglanu wapnia :
Jodometan można następnie otrzymać przez destylację po przemyciu tiosiarczanem sodu w celu usunięcia nadmiaru jodu.
Jodometan można również wytwarzać podczas wypadków jądrowych w reakcji związków organicznych z „jodem fuzyjnym”.
Wybór jodometanu jako czynnika metylującego
Jodometan jest doskonałym środkiem metylującym, ale ma pewne wady. Oprócz toksyczności ; w porównaniu z innymi halogenometanami ( zwłaszcza chlorometanem ) jego masa równoważna jest wyższa: jeden mol MeI waży prawie trzy razy więcej niż jeden mol MeCl. Jednak chlorometan jest gazem (podobnie jak bromometan ), co sprawia, że ich użycie jest delikatniejsze niż jodometan, który jest cieczą. Chlorometan jest znacznie słabszym środkiem metylującym niż MeI, ale jest wystarczający w większości reakcji.
Jodki są generalnie znacznie droższe niż ich chlorki lub odpowiedniki bromkowe, ale niedrogi jodometan nie jest. Na skalę handlową preferowany jest siarczan dimetylu , chociaż toksyczny, ponieważ jest tani i płynny.
Podczas reakcji podstawień nukleofilowych odejście grupy opuszczającej, ja - może prowadzić do reakcji ubocznych , ponieważ jest to silny nukleofil . Wreszcie, ze względu na wysoką reaktywność MeI jest bardziej niebezpieczny dla personelu obsługującego go niż jego bromowane i chlorowane odpowiedniki.
Toksyczność i skutki biologiczne
Jodometan DL 50 przez podawanie doustnego z 76 mg · kg -1 u szczurów i w wątrobie, jest on szybko przekształcany na S-metylo- glutationu . W Stanach Zjednoczonych jodometan jest uważany za potencjalnie rakotwórczy zgodnie z klasyfikacją ACGIH (en) , NTP i EPA . IARC klasyfikuje je w grupie 3 ( „niewywołującą ich rakotwórczy dla człowieka”).
Wdychanie oparów jodometanu może spowodować uszkodzenie płuc, wątroby, nerek i układu nerwowego. Powoduje nudności, zawroty głowy, kaszel i wymioty. Długotrwały kontakt ze skórą powoduje oparzenia. Masywne wdychanie może spowodować obrzęk płuc .
Uwagi i odniesienia
- (fr) Ten artykuł jest częściowo lub w całości zaczerpnięty z artykułu z angielskiej Wikipedii zatytułowanego „ Methyl jodide ” ( zobacz listę autorów ) .
- JODEK METYLU , Karta (y) bezpieczeństwa Międzynarodowego Programu Bezpieczeństwa Chemicznego , konsultacja 9 maja 2009.
- obliczona masa cząsteczkowa od „ atomowych jednostek masy elementów 2007 ” na www.chem.qmul.ac.uk .
- (w) Nicholas P. Chopey, Podręcznik obliczeń inżynierii chemicznej , McGraw-Hill,2004, 3 e ed. , 800 pkt. ( ISBN 978-0-07-136262-7 ) , str. 1.43.
- (w) „ Properties of Various Gases ” na flexwareinc.com (dostęp 12 kwietnia 2010 ) .
- (w) Carl L. Yaws, Podręcznik schematów termodynamicznych: związki nieorganiczne i pierwiastki , t. 1, 2 i 3, Huston, Texas, Gulf Pub. Współ.,1996, 384 pkt. ( ISBN 0-88415-857-8 , 0-88415-858-6 i 0-88415-859-4 ).
- (w) David R. Lide, Podręcznik chemii i fizyki , Boca Raton, CRC,2008, 89 th ed. , 2736 str. ( ISBN 978-1-4200-6679-1 ) , str. 10-205.
- Grupa robocza IARC ds. Oceny ryzyka rakotwórczości dla ludzi , „ Evaluations Globales de la Carcinogenicité pour l'Homme, Groupe 3 : Unclassables as to their carcinogenicity to Humans ” , na http://monographs.iarc.fr , IARC,16 stycznia 2009(dostęp 22 sierpnia 2009 ) .
- Numer indeksowy w tabeli 3.1 w załączniku VI do rozporządzenia WE n O 1272/2008 (16 grudnia 2008).
- „ jodometan ” w bazie produktów chemicznych Reptox z CSST (Quebec organizacji odpowiedzialnej za bezpieczeństwo i higienę pracy), dostęp 25 kwietnia 2009.
- (en) KR Redeker, NY Wang, JC Low, A. McMillan, SC Tyler i RJ Cicerone, „ Emissions of Methyl Halides and Methane from Rice Paddies ” , Science , vol. 290,2000, s. 966–969 ( PMID 11062125 , DOI 10.1126 / science.290.5493.966 ).
- (w) CS King, WW Hartman: Jodek metylu . W: Organie Synthesis , 1943, 2, S. 399 ( artykuł ).
- (w) Johnson, K., „ Metabolism of jodomethane in the rat ” , Biochem J. , tom. 98,1966, s. 38–43.
Bibliografia
- Adams, RE, Browning Jr, WE, Cottrell, WB i Parker, GW (1965) The Release and Adsorption of Methyl Iodide in the HFIR Maximum Credible Accident (nr ORNL-TM-1291) . Narodowe laboratorium Oak Ridge Krajowe laboratorium Oak Ridge. , Tenn.





