Dwutlenek siarki
| Dwutlenek siarki | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Struktura dwutlenku siarki. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nazwa IUPAC | dwutlenek siarki | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonimy |
Siarka |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O ECHA | 100,028,359 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O WE | 231-195-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O RTECS | WS4550000 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 1119 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 18422 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o E | E220 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 3039 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| UŚMIECHY |
O = S = O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / O2S / c1-3-2 InChIKey: RAHZWNYVWXNFOC-UHFFFAOYAT Std. InChI: InChI = 1S / O2S / c1-3-2 Std. InChIKey: RAHZWNYVWXNFOC-UHFFFAOYSA-N |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | bezbarwny gaz lub sprężony gaz skroplony o ostrym zapachu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości chemiczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brute formula | S O 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa cząsteczkowa | 64,064 ± 0,006 g / mol O 49,95%, S 50,05%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moment dwubiegunowy | 1,63305 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Średnica molekularna | 0,382 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości fizyczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fuzja | -75,5 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * Temperatura wrzenia | -10 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rozpuszczalność | w wodzie o temperaturze 25 ° C : 85 ml · l -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametr rozpuszczalności δ | 12,3 J 1/2 · cm -3/2 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
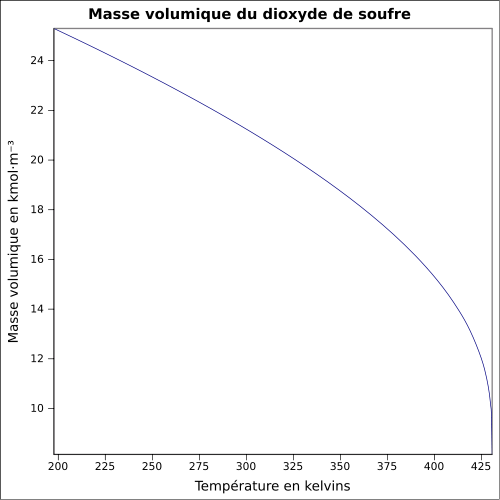
| Masa objętościowa |
1,354 g · cm -3 do -30 ° C 1,434 g · cm -3 do 0 ° C 1,25 g · ml -1 przy 25 ° C 2,26 przy 21 ° C w odniesieniu do powietrza równanie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura samozapłonu | nie palne | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura zapłonu | nie palne | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Granice wybuchowości w powietrzu | niewybuchowy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nasycenie prężności par |
−10 ° C : 1,013 bar 20 ° C : 3,3 bar 40 ° C : 4,4 bar równanie:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punkt krytyczny | 78,9 bar , 157,45 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Szybkość dźwięku | 213 m · s -1 ( 0 ° C , 1 atm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochemia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gaz S 0 , 1 bar | 248,21 J / mol K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gaz Δ f H 0 | -296,84 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° |
24,94 kJ · mol -1 ( 1 atm , -10,05 ° C ); 22,92 kJ · mol -1 ( 1 atm , 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
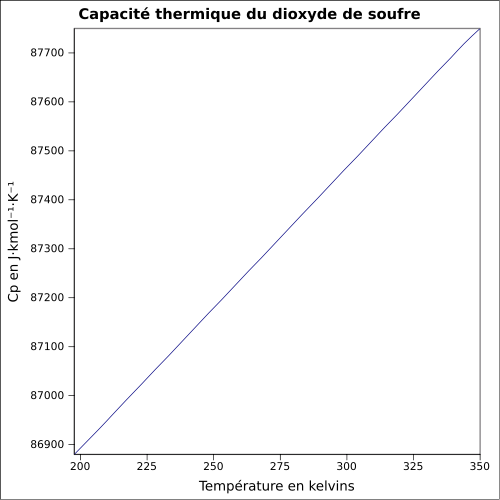
| C p |
równanie:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości elektroniczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 energia re jonizacji | 12,349 ± 0,001 eV (gaz) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości optyczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Współczynnik załamania światła | 1.357 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Środki ostrożności | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Niebezpieczeństwo H314, H331, H314 : Powoduje poważne oparzenia skóry i uszkodzenia oczu H331 : Działa toksycznie przez drogi oddechowe |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, D1A, E, A : Bezwzględne ciśnienie pary sprężonego gazu w temperaturze 50 ° C = 900 kPa D1A : Materiał bardzo toksyczny, powodujący poważne skutki natychmiastowe Transport towarów niebezpiecznych: klasa 2.3 E : Materiał żrący Transport towarów niebezpiecznych: klasa 8 Ujawnienie przy 1,0% zgodnie z ujawnieniem składnika lista |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 0 3 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
268 : trujący i żrący gaz Numer UN : 1079 : DWUTLENEK SIARKI Klasa: 2.3 Etykiety: 2.3 : Gazy toksyczne (odpowiadają grupom oznaczonym przez duże T, tj. T, TF, TC, TO, TFC i TOC). 8 : Substancje żrące   |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klasyfikacja IARC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa 3: niesklasyfikowana ze względu na rakotwórczość dla ludzi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inhalacja | Bardzo toksyczny, martwy, wytwarza w płucach kwas siarkowy. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skóra | Niebezpieczne, żrące, tworzenie się kwasów w kontakcie z mokrymi powierzchniami. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oczy | Niebezpieczne, żrące, tworzenie się kwasów w kontakcie z mokrymi powierzchniami. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Przyjmowanie pokarmu | Stosunkowo niska toksyczność, nieznane skutki długoterminowe. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekotoksykologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CL 50 | 3000 ppm przez 30 min (mysz, inhalacja) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Próg zapachu | niska: 0,33 ppm wysoka: 5 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jednostki SI i STP, chyba że określono inaczej. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dwutlenek siarki , znany również jako dwutlenku siarki , jest związek chemiczny o wzorze SO 2. Jest to bezbarwny, gęsty i toksyczny gaz, którego wdychanie jest silnie drażniące. Jest on uwalniany do atmosfery ziemskiej przez wulkany i przez wielu procesów przemysłowych , a także przez spalania niektórych węgli , olejów i nie- odsiarczonego gazu ziemnego . Utleniania dwutlenku siarki, zazwyczaj w obecności katalizatora , takiego jak dwutlenek azotu NO 2prowadzi do trójtlenku siarki SO 3i kwas siarkowy H 2 SO 4stąd powstawanie kwaśnych deszczy . Powoduje zapalenie układu oddechowego.
Dwutlenek siarki jest stosowany jako środek dezynfekujący , antyseptyczny , antybakteryjny , gaz chłodniczy , wybielacz, gaz katalityczny do rdzeni odlewniczych w procesie Ashland oraz jako środek konserwujący do produktów spożywczych , zwłaszcza suszonych owoców , przy produkcji napojów alkoholowych oraz przy produkcji wino .
Struktura cząsteczki
SO 2jest zgięta cząsteczka, w której atom od siarki znajduje się w stopniu utlenienia +4. Z punktu widzenia teorii orbitalnej cząsteczkowej większość elektronów walencyjnych są zaangażowane w S = O wiązania .
Długość wiązań S = O w SO 2wynosi 143,1 µm , mniej niż to wiązanie w tlenku siarki SO ( 148,1 µm ).
Analogicznie, wiązania O - O w ozonie O 3( 127,8 pm ) są dłuższe niż w tlenie O 2( 120,7 um ).
Podobnie średnia energia wiązania jest wyższa w SO 2( 548 kJ mol −1 ) niż w SO ( 524 kJ mol −1 ), natomiast jest niższy w O 3( 297 kJ mol −1 ) niż w O 2( 490 kJ mol- 1 ).
Te rozważania doprowadziły chemików do wniosku, że wiązania S = O dwutlenku siarki mają rząd wiązań co najmniej równy 2, w przeciwieństwie do wiązań OO ozonu, które są rzędu 1,5.
Produkcja
Dwutlenek siarki można przygotować:
- przez spalanie siarki elementarnej:
- przez spalanie siarkowodoru lub związków siarki organicznej :
- jako pozostałość po produkcji cementu : CaSiO 3i CaSO 4są ogrzewane koksem i piaskiem ( dwutlenek krzemu ):
- od gorącego kwasu siarkowego o miedzi dokumentach
Dwutlenek siarki rozpuszczony w wodzie jest kwasem dwufunkcyjnym i dzieli się go na trzy frakcje według następujących bilansów:
H 2 O + SO 2 H + + HSO 3 - 2 H + + SO 3 2– .Te frakcje zależą od stałych termodynamicznych i pH wina.
Uzyskuje się również uwolnienie SO 2przez zmieszanie pirosiarczynu sodu Na 2 S 2 O 5z kwasem winowym w wodzie, eksperyment oferowany przez niektóre wstępne eksperymenty chemiczne.
Właściwości fizyczne
Ciśnienie pary nasyconej:
| Temperatura | -103,15 ° C | -98,15 ° C | -93,15 ° C | -88,15 ° C | -83,15 ° C | -78,15 ° C | -73,15 ° C | -68,15 ° C | -63,15 ° C |
|---|---|---|---|---|---|---|---|---|---|
| Nacisk | 0,1 kPa | 0,2 kPa | 0,3 kPa | 0,5 kPa | 0,8 kPa | 1,3 kPa | 2,0 kPa | 3,0 kPa | 4,4 kPa |
| Temperatura | -58,15 ° C | -53,15 ° C | -48,15 ° C | -43,15 ° C | -38,15 ° C | -33,15 ° C | -28,15 ° C | -23,15 ° C | -18,15 ° C |
|---|---|---|---|---|---|---|---|---|---|
| Nacisk | 6,3 kPa | 9,0 kPa | 12,6 kPa | 17,3 kPa | 23,3 kPa | 31,1 kPa | 40,9 kPa | 53,2 kPa | 68,3 kPa |
| Temperatura | -13,15 ° C | -8,15 ° C | -3,15 ° C | 1,85 ° C | 6,85 ° C | 11,85 ° C | 16,85 ° C | 21,85 ° C | 26,85 ° C |
|---|---|---|---|---|---|---|---|---|---|
| Nacisk | 86,7 kPa | 109 kPa | 136 kPa | 168 kPa | 205 kPa | 249 kPa | 300 kPa | 359 kPa | 426 kPa |
W przemyśle
W przemyśle dwutlenek siarki wykorzystywany jest przede wszystkim do produkcji kwasu siarkowego . Ten ostatni ma niezliczone zastosowania i jest najczęściej używaną substancją chemiczną, samodzielnie lub w połączeniu z innymi substancjami, takimi jak chlorek tionylu SOCl 2. Dwutlenek siarki uzyskuje się poprzez spalanie siarki lub pirytów , a następnie przekształca się go w trójtlenek siarki (SO 3) bardzo czysty przez utlenianie powietrzem, katalizowane przez pentatlenek platyny lub wanadu . SO 3 otrzymany w ten sposób pozwala na bezpośrednie wytwarzanie wysoko stężonego kwasu siarkowego poprzez prostą hydratację.
Zanieczyszczenie powietrza dwutlenkiem siarki przez przemysł pochodzi głównie ze zużycia paliw kopalnych. Rzeczywiście, w tych paliwach występuje naturalna siarka , a ich spalanie powoduje powstanie SO 2.. Może również pochodzić z przemysłu metalurgicznego , procesów produkcji kwasu siarkowego, przetwarzania ścieru drzewnego na papier, spalania śmieci i produkcji siarki elementarnej.
Spalanie węgla jest najważniejszym źródłem syntetycznym i odpowiada za około 50% globalnej rocznej emisji. Ropa nadal stanowi od 25 do 30%.
Przemysłowe emisje dwutlenku siarki można zmniejszyć poprzez wdrożenie procesów odsiarczania .
W środowisku
SO 2naturalny jest wytwarzany przez wulkany .
Dwutlenek siarki pełni rolę chłodzącą dla planety, ponieważ służy jako jądro zarodkowania dla aerozoli, których albedo jest dość wysokie, to znaczy odbija promienie słoneczne bez ich pochłaniania, ale efekt ten utrzymuje się nie tylko przez kilka lat, gdzie poziom CO 2 osiągnął wiek.
Ostatnia duża erupcja Pinatubo spowodowała uwolnienie do 5000 ton SO 2w powietrzu ( łącznie 17 Mt , największa ilość kiedykolwiek zmierzona nowoczesnymi przyrządami), co wpłynęło na warstwę ozonową i zmieniło pogodę poprzez znaczne ochłodzenie planety i zmianę opadów deszczu przez co najmniej dwa lata. Należy jednak zauważyć, że w 1986 roku antropogeniczne emisje z samych Stanów Zjednoczonych (17,1 Mt ) były porównywalne z rekordową emisją Pinatubo.
Zwolennicy geoinżynierii uważali SO 2jako sposób na powstrzymanie globalnego ocieplenia, „ochłodzenie” planety. Ta metoda została porzucona, ponieważ mogłaby mieć dramatyczne konsekwencje. Rzeczywiście, gdy dwutlenek siarki łączy się z wodą i tlenem atmosferycznym, powodując kwaśne deszcze , które zakłócają lub nawet niszczą delikatne ekosystemy. Dwutlenek siarki , obok dwutlenku azotu, jest jedną z głównych przyczyn kwaśnych deszczy. Ponadto SO 2prowadzi do zakwaszenia oceanów, co zagraża istnieniu planktonu, zwierząt z wapiennymi muszlami i raf koralowych. Jednak planktony wytwarzają połowę ziemskiego tlenu potrzebnego ludziom i zwierzętom.
Zanieczyszczenie powietrza
Dwutlenek siarki jest jednym z głównych zanieczyszczeń atmosfery od początku rewolucji przemysłowej , ze względu na duże ilości węgla, a następnie ropy i gazu spalane przez ludzi, głównie na półkuli północnej . Ma znaczący wpływ na zdrowie publiczne .
Ponadto stężenie dwutlenku siarki w powietrzu powoduje degradację ekosystemów: jest chronicznym zakwaszaczem opadów, a zakwaszenie gleb i osadów sprzyja uwalnianiu metali toksycznych (metali ciężkich, metaloidów, radionuklidów itp. ) Oraz ich biodostępności. .
Emisje dwutlenku siarki są (obok azotanów ) prekursorami kwaśnych deszczy, ale przyczyniają się również do powstawania aerozoli atmosferycznych, które w istotny sposób modyfikują klimat. W dużej mierze dzięki programowi Acid Rain Programu (w) od Agencji Ochrony Środowiska , Stany Zjednoczone znalazły się wśród największych emiterów odnotował 33% spadek od 2002 do 1983 roku emisji Ta poprawa była głównie odsiarczania spalin, technologię, która pozwala na siarkę do odzyskania z gazów odlotowych elektrowni węglowych i naftowych , w szczególności poprzez reakcję z wapnem w celu utworzenia siarczynu wapnia:
CaO + SO 2→ CaSO 3Tlenowe utlenianie CaSO 3daje CaSO 4, Anhydrytu .
Większość gipsu sprzedawanego obecnie w Europie pochodzi z odsiarczania spalin.
W przemysłowym kotle ze złożem fluidalnym siarka może być usuwana z węgla po spaleniu poprzez dodanie kamienia wapiennego jako materiału w złożu. Mówimy o „spalaniu w złożu fluidalnym”.
Siarka może być również usunięta z niektórych paliw (olej, gaz) jeszcze przed spaleniem, co zapobiega tworzeniu się SO 2podczas spalania paliwa i chroni instalacje przed korozyjnym działaniem siarki. Proces Clausa jest stosowany w rafineriach do produkcji siarki jako produktu ubocznego . Proces Stretford został również wykorzystany do usunięcia siarki z paliwa. Wreszcie można zastosować procesy oparte na reakcji redoks na bazie tlenków żelaza, na przykład proces „Lo-Cat”.
Obowiązkowe stosowanie paliw bezsiarkowych do niektórych zastosowań umożliwiło zmniejszenie ilości emitowanych do powietrza od lat 70. XX wieku, ale zwolnienia przyznane transportowi morskiemu i niektórym branżom wyjaśniają emisje, które pozostają wysokie. Również na początku XXI -go wieku, Chiny i Indie, poprzez spalanie dużych ilości węgla, pozostają najwięksi emitenci gazów siarkowych. Niektóre dodatki do paliw (np. Na bazie karboksylanu wapnia i magnezu) mogą być stosowane w silnikach okrętowych w celu zmniejszenia emisji dwutlenku siarki do atmosfery.
W 2006 r. Chiny były największym na świecie zanieczyszczającym dwutlenkiem siarki, głównie produkując towary konsumpcyjne do użytku w innych krajach („szara emisja”). W 2005 r. Chińskie emisje oszacowano na 23,1 Mt , prawie porównywalne z emisjami w Stanach Zjednoczonych w 1980 r., I gwałtownie rosły (wzrost o ponad 27% w ciągu pięciu lat od 2000 do 2005). Aby mniej cierpieć z powodu kwaśnego opadu z Chin, w 2007 roku Japonia zdecydowała się pomóc im w rozwijaniu czystej energii .
W przemyśle spożywczym
Jest szeroko stosowany w przemyśle spożywczym i agrobiznesie i występuje głównie w:
- wina, głównie różowe i białe, które mają mniej garbników niż wina czerwone i dlatego ulegają silniejszemu utlenianiu. Dwutlenek siarki pozwala to zmniejszyć;
- octy;
- suszony owoc;
- Mięsa, galaretki stosowane w wędlinach, piwach i innych napojach fermentowanych;
- wyroby cukiernicze, dżemy, owoce kandyzowane, galaretki, marmolady, syropy itp.
W winifikacji
W winie dwutlenek siarki występuje w postaci uwodnionej wolnej: H 2 SO 3lub kwas siarkawy , który w 2/3 łączy się ze składnikami wina. Mamy więc SO 2ogółem = SO 2wolny + SO 2 łączny.
Część wolnej porcji działa jako ochrona wina przed mikroorganizmami powodującymi psucie. Ta część nazywa się SO 2aktywny lub SO 2molekularny. SO 2może występować w połączeniu z aldehydami (etanalem), ketonami (kwas alfa-ketoglutarowy) i niektórymi cukrami, dając trwały związek. Ciało utworzone przez połączenie dwutlenku siarki i etanalu to kwas aldehydowo-siarkowy lub kwas etanolosulfonowy, który jest mocnym kwasem , zgodnie z następującą reakcją:
CH 3 CHO + NaH SO 3 → CH 3 CHOH-O-SO 2 NaW zależności od dawki dwutlenek siarki hamuje lub hamuje rozwój drożdży i bakterii , które można wykorzystać do mutacji win słodkich lub syropowych lub po prostu do zabezpieczenia wina. Podczas produkcji wina wprowadzenie dwutlenku siarki pozwala na wyselekcjonowanie drożdży z gatunku Saccharomyces cerevisiae, które są bardziej odporne na dwutlenek siarki niż drożdże innych rodzajów, np. Pichia anomala (en) (syn. Hansenula ). Istnieją różne metody analityczne do pomiaru SO 2 w winach.
Zdrowie i przepisy
Dwutlenek siarki lub E220 mogą spowodować zagrożenie dla zdrowia w następujących przypadkach:
- podczas jego wdychania;
- po spożyciu;
- w kontakcie ze skórą i błonami śluzowymi.
Podczas jego spożycia narządy wykazujące najwyższą aktywność oksydazy siarczynowej są bardziej skłonne do detoksykacji go z moczem. Trwałość pochodnych SO 2można rozważyć poprzez nadmierne spożycie. Dla użytkownika siarczyny są bardzo silnymi nukleofilami, które nie powodują ostrej toksyczności, ale mogą powodować silne lub poważne alergie. Niszczy witaminę B 1 (lub tiaminę ) przy pH = 6, może powodować podrażnienie żołądka, którego należy unikać u pacjentów z nerkami. Zatem ADI ustalone przez WHO wynosi 0,7 mg kg- 1 masy ciała dziennie.
W większości przypadków objawy pojawiają się kilka minut po spożyciu pokarmów zawierających siarczyny. Zanieczyszczenie powietrza SO 2odegrałby również rolę w pojawieniu się tych reakcji nietolerancji. Ponadto osoby z astmą są znacznie bardziej wrażliwe niż przeciętna osoba.
Europejskie przepisy zobowiązują obecnie producentów do umieszczania napisów „Zawiera siarczyny”, jeśli jego stężenie przekracza 100 mg l −1 . W Kanadzie SAQ ogranicza stężenie do 50 ppm dwutlenku siarki w stanie wolnym i 300 ppm dwutlenku siarki w stanie połączonym.
W obecnym kontekście, w którym szacunek dla środowiska i żywności ekologicznej jest coraz bardziej zalecany, plantatorzy winorośli, a nawet konsumenci, skłaniają się obecnie ku winom ekologicznym z zawartością SO 2.są mniejsze, ale do których stosuje się SO 2pozostaje upoważniony. Zwróć uwagę, że w porównaniu z innymi krajami na świecie (Kanada, Szwajcaria lub Stany Zjednoczone), zasady włączenia SO 2podczas winiarstwa są znacznie bardziej restrykcyjne, w Europie jeszcze ostrzejsze. Producenci win naturalnych dążą do maksymalnego ograniczenia dodatku dwutlenku siarki.
Poniższa tabela przedstawia zauważalne różnice w stężeniach SO 2 łącznie w tych różnych krajach:
| SO 2 w mg / l | NOP (USA) „ Wykonane z ekologicznych winogron ” SO 2 całkowity |
Bio Canada | Szwajcarski pączek | Demeter SO 2 łącznie (5 lat) |
|---|---|---|---|---|
| Wytrawne czerwone (cukier < 5 g l -1 ) |
100 | 100 | 120 | 70 |
| białe / różowe wytrawne (cukier < 5 g l -1 ) |
100 | 100 | 120 | 90 |
| białe / różowe wytrawne (cukier < 5 g l -1 ) |
100 | 150 | 170 | 70 |
| Biały / różowy (cukier> 5 g l -1 ) |
100 | 150 | 170 | 130 |
| Wino likierowe (cukier> 5 g l - 1 ) |
100 | 250 | 170 | 80 |
Poważne incydenty we Francji
Plik 22 czerwca 2011przez 7 h 45 problem techniczny przy zamknięciu zaworu w rafinerii Feyzin (należącej do grupy Total ) wypuścił dużą chmurę dwutlenku siarki, popychaną przez wiatr z południa nad Lyonem . Kilka osób trafiło do szpitala, a firmy ewakuowano.
Prefektura , który starał się uspokoić ludność, zaleca „do wentylacji domów i biur” , dając instrukcje przeciwnego do tych z strażaków , który doradzał ludziom „pobytu w domu i zamknąć okna” .
Uwagi i odniesienia
- DWUTLENEK SIARKI , karta (e) bezpieczeństwa Międzynarodowego Programu Bezpieczeństwa Chemicznego , konsultacja 9 maja 2009.
- (w) David R. Lide, Podręcznik chemii i fizyki , Boca Raton, CRC,16 czerwca 2008, 89 th ed. , 2736 str. ( ISBN 978-1-4200-6679-1 ) , str. 9-50.
- (en) Yitzhak Marcus, Właściwości rozpuszczalników , t. 4, Anglia, John Wiley & Sons,1999, 239 pkt. ( ISBN 0-471-98369-1 ).
- obliczona masa cząsteczkowa od „ atomowych jednostek masy elementów 2007 ” na www.chem.qmul.ac.uk .
- (en) Robert H. Perry i Donald W. Green , Perry's Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , str. 2-50.
- (w) „ Properties of Various Gases ” na flexwareinc.com (dostęp 12 kwietnia 2010 ) .
- (w) W. M Haynes, Handbook of Chemistry and Physics , CRC, 2010-2011 91 th ed. , 2610 s. ( ISBN 9781439820773 ) , str. 14-40.
- (w) Irvin Glassman i Richard A. Yetter, Combustion , Amsterdam / Boston, Elsevier,2008, 4 th ed. , 773 s. ( ISBN 978-0-12-088573-2 ) , str. 6.
- (w) David R. Lide, CRC Handbook of Chemistry and Physics , CRC Press,2009, 90 th ed. , 2804 s. , Twarda oprawa ( ISBN 978-1-4200-9084-0 ).
- (w) David R. Lide, Podręcznik chemii i fizyki , Boca Raton, CRC,2008, 89 th ed. , 2736 str. ( ISBN 978-1-4200-6679-1 ) , str. 10-205.
- „Sulphur dwutlenek” w ESIS (dostęp 13 lutego 2009).
- Grupa robocza IARC ds. Oceny ryzyka rakotwórczości dla ludzi , „ Global Carcinogenicity Assessments for Humans, Group 3 : unclassifiable as to their carcinogenicity for human ” , on monographs.iarc.fr , IARC,16 stycznia 2009(dostęp 22 sierpnia 2009 ) .
- Numer indeksowy w tabeli 3.1 w załączniku VI do rozporządzenia WE n o 1272/2008 [PDF] 16 grudnia 2008 roku.
- „ dwutlenek siarki ” w bazie produktów chemicznych Reptox z CSST (Quebec organizacji odpowiedzialnej za bezpieczeństwo i higienę pracy), dostęp 23 kwietnia 2009.
- (in) „ Sulphur dwutlenek ” na hazmap.nlm.nih.gov (dostęp: 14 listopada 2009 ) .
- (w) AF Holleman i E. Wiberg, „ Inorganic Chemistry ”, Academic Press , San Diego, 2001 ( ISBN 0-12-352651-5 ) .
- (w) Norman N. Greenwood i A. Earnshaw, „ Chemistry of the Elements ”, Butterworth-Heinemann 2 e ed. , s. 700 , Oxford, 1997 ( ISBN 0-08-037941-9 ) .
- (w) David R. Lide, CRC Handbook of Chemistry and Physics , CRC Press,2009, 90 th ed. , 2804 s. , Twarda oprawa ( ISBN 978-1-4200-9084-0 ) , s. 6-105.
- Stephen Self i in. , Atmospheric Impact of the 1991 Mount Pinatubo Eruption , Fire and Mud: Eruptions and Lahars of Mount Pinatubo, Philippines, 1997
- Dwutlenek siarki , EPA
- Hogan, C. Michael, „Czynnik abiotyczny” w Encyclopedia of Earth , 2010, Emily Monosson i C. Cleveland (red.), National Council for Science and the Environment, Washington DC.
- (w) Michael R. Lindeburg , Podręcznik inżynierii mechanicznej do egzaminu PE , Belmont, CA, Professional Publications, Inc.2006, 1296 s. ( ISBN 978-1-59126-049-3 ) , str. 27–3.
- Często zadawane pytania dotyczące usuwania i odzyskiwania siarki za pomocą systemu usuwania siarkowodoru LO-CAT . gtp-merichem.com
- Analiza przesiewowa procesu alternatywnej obróbki gazu i usuwania siarki do zgazowania [PDF] , grudzień 2002, raport SFA Pacific, Inc. przygotowany dla Departamentu Energii Stanów Zjednoczonych (dostęp 31 października 2011).
- Maj, Walter R., Marine Emissions Abatement , SFA International, Inc., str. 6 .
- Chiny przeżywają najgorszy okres kwaśnych deszczy , United Press International , 22 września 2006.
- Michel Temman, „Ofiara jego odrzucenia, Tokio pomaga Pekinowi stać się zielonym”, Wyzwolenie , 16 kwietnia 2007, [ czytaj online ] .
- Kanadyjskie Centrum Bezpieczeństwa i Higieny Pracy .
- Przeczytaj online .
- Przeczytaj online .
- Zasady ekologicznej produkcji wina we Francji i za granicą [PDF] , na milleime-bio.com .
- Przeczytaj online .
- Przeczytaj online .
- Czytaj online w 20minutes.fr .
Zobacz też
Powiązane artykuły
Linki zewnętrzne
- Francuski Instytut Środowiska .
- Brytyjski rządowy program informacji o atmosferze, klimacie i środowisku .